(14分)下表所示的是第二周期元素中,除Be、B、Ne三种元素外,其它元素的简单氢化物的沸点;题26图所示是第三周期元素中,除Ar以外的其它元素的单质的熔点变化关系。
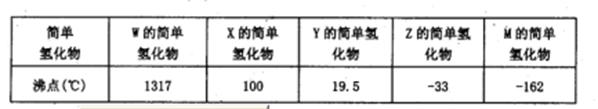
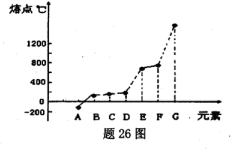
(1)X的简单氢化物属于 分子(填“极性”或“非极性”),G元素的单质在固态时的晶体类型为___ _。
(2)写出W的氢化物的电子式 ______。
(3)A和Z两元素形成的一种化合物分子中各原子最外均达到8电子稳定结构,则该分子的结构式为 。
(4)化合物AY能与水反应生成两种弱酸,其化学方程式为
(5)写出元素F的单质与三氧化二铬反应的化学方程式___
(1)极性(2分),原子晶体(2分) (2)Li+[:H]-(2分)
(3) 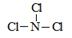 (2分) (4)ClF+H2O=HClO+HF(3分)
(2分) (4)ClF+H2O=HClO+HF(3分)
(5)2Al+Cr2O3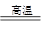 Al2O3+2Cr(3分)
Al2O3+2Cr(3分)
(1)X的氢化物的沸点是100℃,所以X是水,属于极性分子。G单质的熔点最高,应该是单质硅,属于原子晶体。
(2)W的氢化物最高,应该是离子化合物,而在第二周期中能析出离子晶体的是LiH,电子式为Li+[:H]-。
(3)A的熔点最低,应该是氯气。Z的氢化物沸点仅比M的氢化物沸点高,所以Z是氮元素。由于化合物分子中各原子最外均达到8电子稳定结构,所以是NCl3,结构类似于氨气,所以结构式为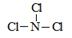 。
。
(4)Y是F,非金属性最强,所以ClF和水反应的方程式为ClF+H2O=HClO+HF。
(5)F单质的熔点仅比硅的底,所以F是铝。发生铝热反应,反应式为2Al+Cr2O3 Al2O3+2Cr。
Al2O3+2Cr。
