镍(Ni)可形成多种配合物,且各种配合物均有广泛的用途。
(1)配合物Ni(CO)4常温下呈液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于________晶体;写出两种与配体CO互为等电子体的粒子的化学式________、________。
(2)某镍配合物结构如下图所示,分子内含有的作用力有________(填序号)。
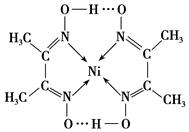
A.氢键
B.离子键
C.共价键
D.金属键 E.配位键(3)很多不饱和有机物在Ni催化下可与H2发生加成反应,如
① ②
② 、③
、③ 、④ HCHO等,其中碳原子采取sp2杂化的分子有________(填序号);HCHO分子的空间构型为________ 。
、④ HCHO等,其中碳原子采取sp2杂化的分子有________(填序号);HCHO分子的空间构型为________ 。
(4)据报道,含有镁、镍和碳三种元素的某种晶体具有超导性,其结构如下图所示。则该晶体的化学式为________。晶体中每个镁原子周围距离最近的镍原子有________个。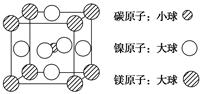
(共12分) (1)分子 (1分) N2(1分)CN-(1分) (2)ACE(2分)
(3)①③④(2分) 平面三角形(1分) (4)MgNi3C(2分) 12(2分)
(1)根据相似相溶原理可知,化合物是非极性分子,所以形成的晶体是分子晶体。电子数和原子数分布都相等的分子是等电子体,所以和CO互为等电子体的是氮气或CN-。
(2)根据配合物结构可判断,分子中不存在离子键和金属键,所以答案选ACE。
(3)①③④都是平面型结构,所以是sp2杂化。乙炔是直线型结构,是sp杂化。HCHO分子中碳原子没有孤对电子,是sp2杂化,所以是平面三角形结构。
(4)根据晶胞的结构可知,碳原子全部在晶胞中,共有1个。镁原子在面心处,共有6×1/2=3个。镍原子在顶点处,共有8×1/8=1个,所以化学式为MgNi3C。晶体中每个镁原子周围距离最近的镍原子位于面心处,所以共有3×8÷2=12个。
