问题
计算题
(6分).在反应MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O中,若二氧化锰与足量的浓盐酸反应制得3.55gCl2,试求:
MnCl2+Cl2↑+2H2O中,若二氧化锰与足量的浓盐酸反应制得3.55gCl2,试求:
(1)反应消耗的氧化剂的质量;
(2)反应消耗的HCl的物质的量。
答案
(6分)
(1)4.35克
(2)0.2mol
题目分析:
(1)n(Cl2)="3.55g÷71g/mol=0.05mol" ,氧化剂是二氧化锰。
MnO2+4HCl(浓)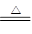 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
1 1
n(MnO2) 0.05mol
n(MnO2)=0.05mol
m(MnO2)=0.05mol×87g/mol=4.35g
(2)反应消耗的HCl的物质的量n(HCl)="4×0.05" mol=0.2mol
点评:直接根据方程式进行简单的化学计算,属于较简单题。
