I.根据价层电子对互斥理论(VSEPR)可以判断分子或离子的空间构型。
请回答下列问题:
①解释CO2为直线型分子的原因 ;
② PbCl2分子的立体构型为 ,该分子属于 分子(填“极性”或“非极性” ),其中Pb原子的杂化轨道类型为 。
II.铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域。回答下列问题:
(1)铜原子基态电子排布式为 ;
(2)用晶体的X射线衍射法可以测得阿伏伽德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361pm。又知铜的密度为9.00g/cm3,则铜晶胞的体积是
cm3,晶胞的质量是 克,阿伏伽德罗常数为
(列式计算,已知Ar(Cu)=63.6)。
I. (1) ①CO2属n+m=2,SP杂化,故为直线形 (每空2分)
②折线形(或V形) 极性分子 SP2 (每空1分)
II.(1)1s22s22p63s23p63d104s1 (2)4.70×10-23 4.23×10-22
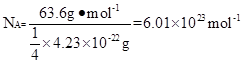
I. (1)CO2中中心原子碳原子的孤对电子对数是(4-2×2)÷2=0,即碳原子是sp杂化,所以是直线型结构。
②PbCl2中中心原子Pb原子的孤对电子对数是(4-1×2)÷2=1,即Pb原子是sp2杂化,所以是V型结构。
II.(1)根据构造原理可知,基态铜原子的电子排布式为1s22s22p63s23p63d104s1 。
(2)边长是361pm,所以体积是 。根据密度可知晶胞的质量是
。根据密度可知晶胞的质量是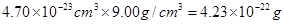 。由于铜晶胞中含有的铜原子数是8×1/8+6×1/2=4,所以有
。由于铜晶胞中含有的铜原子数是8×1/8+6×1/2=4,所以有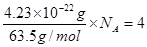 ,因此
,因此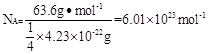 。
。
