问题
问答题
一种矿物主要由原子核电荷数均少于18的A、B、C三种元素组成.经测定:A元素原子核内无中子,B3+有两个电子层,C的第二层电子数为第一层的3倍,该矿物的主要成分中含有由A、C元素形成的原子团,该矿物的主要成分的相对分子质量为78.回答下列问题:
(1)元素名称:A为______;B为______.
(2)B3+的结构示意图为______.
(3)该矿物主要成分的化学式为______.
答案
A元素原子核内没有中子,说明A是氢元素.
B3+的有两个电子层,说明最外层即第三层已经失去,且原子的最外层为3,所以质子数应该为2+8+3=13,为铝元素.
C的第二层电子数为第一层的3倍,而第一层为2,所以第二层为6,由于第二层没有达到稳定结构,所以不存在第三层,所以C的质子数为2+6=8,为氧元素.
由于矿石是有氢、氧、铝元素组成,且氢氧形成原子团,所以为氢氧根,而氢氧根为-1价,铝元素在化合物中为+3价,所以化合物为Al(OH)3.其相对分子质量为27+(1+16)×3=78.
故答案为:
(1)氢; 铝.
(2)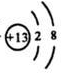 .
.
(3)Al(OH)3.
