(1)甲、乙、丙、丁是初中化学常见的化合物,甲和乙中含有碳元素,丙能做干燥剂.它们之间有如图1所示的转化关系(部分物质和反应条件已略去).则甲的化学式为______;丙转化为丁的化学力.程式为______.
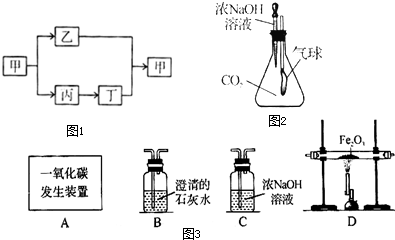
(2)图2是某趣味实验装置图.挤压胶头滴管后,可观察到气球胀大的现象.请分析其原因,并写出化学方程式.
(3)利用图3装置可做CO还原Fe2O3,的实验,并检验该反应生成的气体产物.已知由A装置制取的CO气体中混有少量的CO2.
①CO与Fe2O3反应的化学方程式为______.
②气体通过装置的顺序是A→______(装置不能重复使用).
③从环保角度考虑,对以上装置的改进措施是______.
(4)称取12.5g石灰石(主要成分是CaCO3,杂质不参加反应)放人烧杯中,向其中加入50g稀盐酸,二者恰好完全反应.反应结束后称量烧杯中剩余物质的总质量为58.1g(不包括烧杯的质量,且气体的溶解忽略不计).试计算石灰石中杂质的质量分数.
(1)甲和乙中含有碳元素,丙能做干燥剂,所以丙是氧化钙,甲是碳酸钙,乙就是二氧化碳,氧化钙和水反应生成氢氧化钙,所以丁是氢氧化钙,碳酸钙在高温的条件下生成氧化钙和二氧化碳,氧化钙和水反应生成氢氧化钙,氢氧化钙和二氧化碳反应生成白色的碳酸钙沉淀和水,推出的各种物质均满足题中的转化关系,推导合理,所以甲的化学式为CaCO3,
氧化钙和水反应生成氢氧化钙,化学方程式为:CaO+H2O=Ca(OH)2;
(2)氢氧化钠溶液能与二氧化碳反应生成碳酸钠和水,而使瓶内的气体被消耗,压强变小,气球变大,所以原因是:二氧化碳被浓NaOH溶液吸收,锥形瓶内的气压减小,外界大气压大于锥形瓶内的气压,使气球胀大.化学方程式为:2NaOH+CO2═Na2CO3+H2O;
(3)①一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,化学方程式为Fe2O3+3C0
2Fe+3CO2,②混合气体通过C装置,浓氢氧化钠溶液吸收由A装置制取的CO气体中混有少量的CO2,然后CO进入D装置,发生CO还原Fe2O3的反应,生成二氧化碳和铁,检验二氧化碳应用澄清石灰水,所以顺序为C→D→B,高温 .
③一氧化碳有毒,排放到空气中会污染空气,装置的改进措施是:将尾气点燃或进行收集处理;
(4)依据质量守恒定律可知生成CO2的质量为:12.5g+50g-58.1g=4.4g
设石灰石中CaCO3的质量为x.
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 44
x4.4g
=100 x 44 4.4g
x=10g
所以样品中杂质的质量是:12.5g-10g=2.5g
石灰石中杂质的质量分数为:
×100%=20% 2.5 12.5
答:石灰石中杂质的质量分数为20%.
故答案为:(1)CaCO3,CaO+H2O=Ca(OH)2;
(2)二氧化碳被浓NaOH溶液吸收,锥形瓶内的气压减小,外界大气压大于锥形瓶内的气压,使气球胀大.化学方程式为:2NaOH+CO2═Na2CO3+H2O;
(3)Fe2O3+3C0
2Fe+3CO2,C→D→B,将尾气点燃或进行收集处理;高温 .
(4)依据质量守恒定律可知生成CO2的质量为:12.5g+50g-58.1g=4.4g
设石灰石中CaCO3的质量为x.
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 44
x 4.4g
=100 x 44 4.4g
x=10g
所以样品中杂质的质量是:12.5g-10g=2.5g
石灰石中杂质的质量分数为:
×100%=20% 2.5 12.5
答:石灰石中杂质的质量分数为20%.
