食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下
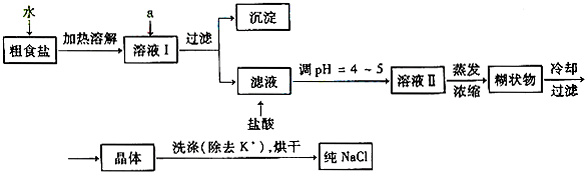
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
① 欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为__________
(只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为__________________。
(2)用提纯的NaCl配制500mL4.00 mol·L-1NaCl溶液
① 本次实验所用仪器除药匙、玻璃棒外还有_____________(填仪器称)。
②用托盘天平称取的NaCl晶体的质量为:_____________;
③在配制溶液的过程中多次用到玻璃棒,在溶解时玻璃棒的作用是:_____________, 在移液时玻璃棒的作用是:__________________。
④观察液面时,若俯视刻度线,会使所配制的溶液的浓度_________(填“偏高”、“偏低” 或“无影响”,下同);加蒸馏水时不慎超过了刻度线后倒出部分溶液,使液面与刻度线相切,会__________;
(3)用ρ=1.84g·mL-1,质量分数为98%的浓硫酸配制200mL1mol·L-1的稀硫酸与上述配制溶液的步骤上的差别主要有三点:
①计算:理论上应取浓硫酸的体积V=___________mL(精确到小数点后两位);
②量取:由于量筒是一种粗略的量具,如想精确量取,必需选用_____________(填仪器名称)。
③溶解:稀释浓硫酸的方法_________________________________________。
(1)①BaCl2、NaOH、Na2CO3;②75%乙醇
(2)①天平、烧杯、500mL容量瓶、胶头滴管;②117.0g;③搅拌加速溶解;引流;④偏高;偏低
(3)①10.87;②酸式滴定管;③将浓硫酸沿器壁慢慢注入水中,并不断搅拌,使稀释产生的热量及时散出
