问题
实验题
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
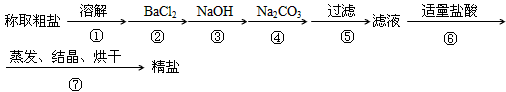
(1)判断BaCl2已过量的方法是___________________。
(2)第④步中,写出相应的离子方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)
____________________。
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是____________________。
(4)为检验精盐纯度,需配制250mL 0.2mol/L NaCl(精盐)溶液,题图是该同学转移溶液的示意图,图中的错误是___________________________。
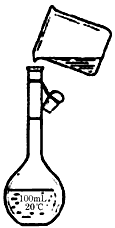
答案
(1)取第②步后的上层清液(或取少量上层清液于试管中),再滴入适量BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量(答案合理即可)
(2)Ca2++CO32-=CaCO3↓;Ba2++CO32-=BaCO3↓
(3)在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度
(4)未用玻璃棒引流,未采用250mL容量瓶
