按要求完成下列问题。
(1)写出Mg2+的电子排布式 。
(2)依次指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:________、________、________。
(3)判断BCl3分子的空间构型、中心原子成键时采取的杂化轨道类型及分子中共价键的键角:________、________、________。
(4)下列分子中若有手性分子,请用“*”标出其手性碳原子。
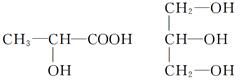
(1)1s22s22p6 (2) Co3+、CN-、 6 (3) 平面正三角形、sp2 、120°
(4) 
题目分析:(1)根据构造原理可知,镁离子的电子排布式1s22s22p6。
(2)根据配合物的结构简式可知,在配合物K3[Co(CN)6]中的中心离子是Co3+,配位体是CN-,配位数是6。
(3)三氯化硼分子中B原子含有的孤对电子对数=(3-3×1)÷2=0,所以不存在孤对电子,则该分子是平面正三角形结构,键角是120°,B原子是sp2杂化。
(4)如果饱和碳原子连接的4个原子或基团各不相同,则该碳原子就是手性碳原子,所以含有手性碳原子的是 。
。
点评:该题是高考中的常见题型,属于基础性试题的考查。试题紧扣教材,基础性强,有利于培养学生灵活运用基础性知识解决实际问题的能力的培养,也有利于培养学生的应试能力和学习积极性。

