为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
(1)第⑤步实验操作需要烧杯、______、______等玻璃仪器.
(2)步骤2中,判断加入BaCl2已过量的方法是:______
(3)除杂试剂BaCl2、NaOH、Na2CO3、加入的顺序还可以是(用化学式回答)______.
(4)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是______.
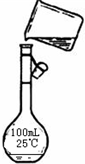
(5)为检验精盐纯度,需配制200mL 1mol/L NaCl(精盐)溶液,如图是该同学转移溶液的示意图,图中的错误是:______
(6)配制过程中,下列操作情况会使结果偏低的是______
A.称量时,托盘天平左盘加砝码,右盘加氯化钠
B.移液前,容量瓶中有少量蒸馏水未倒出
C.定容时,俯视容量瓶刻度线观察液面
D.定容后,倒置容量瓶摇匀经平放静置,液面低于刻度线,再加水定容.
(1)实现沉淀和溶液分离的方法是过滤,用到的玻璃仪器有:烧杯、漏斗、玻璃棒,故答案为:漏斗;玻璃棒;
(2)向溶液中加入氯化钡,是为了除去硫酸根离子,如果氯化钡过量,则硫酸根离子已经除净,反之回升逾硫酸根,可以在②步后的上层清液中,再滴入氯化钡溶液,若溶液未变浑浊,则说明所加的氯化钡已过量,
故答案为:在②步后的上层清液中,再滴入氯化钡溶液,若溶液未变浑浊,则说明所加的氯化钡已过量;
(3)镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以正确的顺序为:NaOH、BaCl2、Na2CO3或BaCl2、NaOH、Na2CO3,
故答案为:NaOH、BaCl2、Na2CO3或BaCl2、NaOH、Na2CO3;
(4)若先用盐酸调pH值再过滤,这样生成的氢氧化镁、碳酸钙、碳酸钡等均会溶解于盐酸中,影响精盐的纯度,
故答案为:在此酸度条件下,会有部分沉淀溶解,影响精盐的纯度;
(5)配制200mL 1mol/L NaCl(精盐)溶液在移液这一步中,为防止液体外溅,一定要用玻璃棒引流,配制200mL的溶液应选用200mL的容量瓶,故答案为:未用玻璃棒引流,未使用200mL的容量瓶;
(6)A.称量时,托盘天平左盘加砝码,右盘加氯化钠,则实际称得的氯化钠质量是砝码减游码质量,氯化钠的物质的量偏低,故实验结果偏低,故A正确;
B.移液前,容量瓶中有少量蒸馏水未倒出,不影响实验结果,故B错误;
C.定容时,俯视容量瓶刻度线观察液面,则溶液的体积不足200mL,所以浓度偏高,故C错误;
D.定容后,倒置容量瓶摇匀经平放静置,液面低于刻度线,再加水定容,相当于把溶液稀释了,故结果偏低,故D正确.
故选AD.
