问题
问答题
在除杂质的实验操作中,为了将溶液中的杂质完全去除,通常需加入过量的除杂质试剂.某校化学课外活动小组为了除去粗盐中含有少量Na2SO4、MgCl2,设计了下列实验步骤:
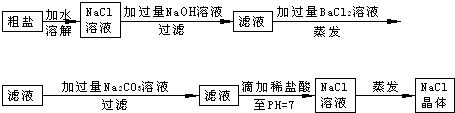
试简要说明:
(1)加入过量BaCl2的溶液的原因______.
(2)判断BaCl2已过量的方法是______
(3)加入过量Na2CO3的溶液的原因______.
(4)滴加稀盐酸直至pH=7的目的是______;写出这时反应的化学方程式______.
答案
(1)在粗盐提纯时,加入过量的氯化钡的目的是除去硫酸根离子,并将之除尽,故答案为:使硫酸根离子完全沉淀而除去;
(2)氯化钡过量时,加入硫酸会产生白色沉淀,可以通过检验钡离子来确定氯化钡是否过量,故答案为:取少量上层清液加入到试管中,向其中滴加稀硫酸,如果产生白色沉淀,证明氯化钡过量;
(3)粗盐溶液中的钙离子可以加碳酸钠来去除,所以碳酸钠的作用是:使钡离子完全沉淀而除去,故答案为:使钡离子完全沉淀而除去;
(4)在粗盐提纯时,最后一步加盐酸,滴加稀盐酸可以除去过量的氢氧根和碳酸根,发生的反应有:
HCl+NaOH=NaCl+H2O,2HCl+Na2CO3=2NaCl+H2O+CO2↑,最后得到氯化钠溶液,
故答案为:除去过量的氢氧根和碳酸根,得到氯化钠溶液;HCl+NaOH=NaCl+H2O,2HCl+Na2CO3=2NaCl+H2O+CO2↑.
