纯净的过氧化钙(CaO2)难溶于水、乙醇,常温下较为稳定。CaO2·8H2O在0℃时稳定,加热至130℃时逐渐变为无水CaO2。在实验室可用钙盐制取CaO2·8H2O,再经脱水制得CaO2。其制备过程如下
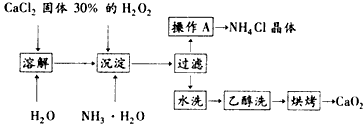
根据以上信息,回答下列问题:
(1)用上述方法制取CaO2·8H2O的化学方程式是________________________;
(2)操作A的步骤为______________________:
(3)检验“水洗”已经洗净的方法是_____________________;
(4)测定产品中CaO2的含量的实验步骤是(已知:I2 + 2S2O32- = 2I- + S4O62-):
第一步:准确称取ag产品于锥形瓶中,加入适量蒸馏水和过量的bg KI晶体,再滴入适量2 mol/L的H2SO4
溶液,充分反应;
第二步:向上述锥形瓶中加入几滴淀粉溶液;
第三步:逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液VmL。
①第三步反应完全时的现象为______________________;
②产品中CaO2的质量分数为___________(用字母表示);
③某同学经实验测得产品中CaO2的质量分数偏高,造成偏高的原因是(测定过程中由操作产生的误差忽略不计,用离子方程式表示)______________________。
(1) CaCl2+H2O2+2NH3·H2O+6H2O=CaO2·8H2O↓+2NH4Cl
(2)向滤液中加入适量HCl,蒸发浓缩,冷却结晶,过滤,洗涤,干燥
(3)取少许最后一次洗涤液,向其中加入稀硝酸酸化的硝酸银溶液,若不产生白色沉淀,则说明已经洗净 (4)①溶液蓝色褪去;②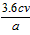 %;③4H+ +4I- +O2 = 2I2 +2H2O
%;③4H+ +4I- +O2 = 2I2 +2H2O
