钢铁生锈的过程十分复杂,已知某铁锈含有Fe2O3·H2O(n≤1),还可能有Fe(OH)3和FeCO3。某学习小组做了以下实验。
①取12.574g铁锈隔绝空气加热至恒重,得到固体10.528g。
②另取6.287g铁锈,在205.00mL1.000mol/L的稀硝酸中恰好完全溶解,产生NO气体89.60mL(标准状况)。
(1)根据实验①,铁锈中是否只含Fe2O3·nH2O?试通过计算回答。
(2)根据实验②.能否确定铁锈中含有FeCO3?理由是什么?
(3)若n=0.8,试通过计算确定6.287g铁锈的成分以及它们的物质的量。
参考答案:
(1)否;若只含Fe2O3·nH2O,则Fe2O3与H2O的物质的量之比为(10.528÷160):[(12.574-10.528)÷18]=0.0658:0.114=1:1.75,n>1,不合题意
(2)有,因为只有FeCO3显还原性
(3)实验①中铁锈加热失去水分和CO2,发生的反应为
 、
、
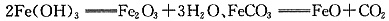 ;实验②中FeCO3与硝酸发生氧化还原反应,Fe(OH)3和Fe2O3·nH2O与硝酸发生中反应,方程式为
;实验②中FeCO3与硝酸发生氧化还原反应,Fe(OH)3和Fe2O3·nH2O与硝酸发生中反应,方程式为
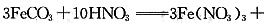
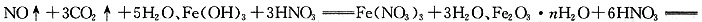 2Fe(NO3)3+(n+3)H2O
2Fe(NO3)3+(n+3)H2O
设6.287g铁锈中Fe2O3·0.8H2O、Fe(OH)3和FeCO3的物质的量分别为xmol,ymol,zmol,则有
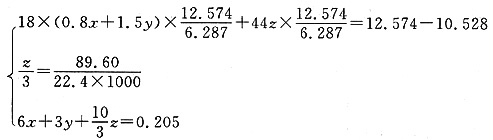
联立以上方程组可以得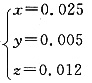
故Fe2O3·0.8H2O:0.025mol;Fe(OH)3:0.005mol;FeCO3:0.012mol
