原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)W原子的核外电子排布式为_________。
(2)均由X、Y、Z三种元素组成的三种常见物质A、B、C分别属于酸、碱、盐,其化学式依次为_________、__________、_________,推测盐中阴离子的空间构型为__________,其中心原子杂化方式为__________。
(3)Z、W两种元素电负性的大小关系为____;Y、Z两种元素第一电离能的大小关系为____。
(4)CO的结构可表示为C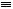 O,元素Y的单质Y2的结构也可表示为Y
O,元素Y的单质Y2的结构也可表示为Y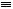 Y。右表是两者的键能数据(单位:kJ·mol-1):
Y。右表是两者的键能数据(单位:kJ·mol-1):
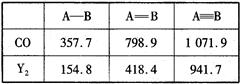
①结合数据说明CO比Y2活泼的原因:_____。
②意大利罗马大学Fulvio Cacace等人获得了极具研究意义的Y4分子,其结构如图所示,请结合上表数据分析,下列说法中,正确的是_____。
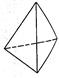
A.Y4为一种新型化合物 B.Y4与Y2互为同素异形体
C.Y4的沸点比P4(白磷)高 D.1 mol Y4气体转变为Y2将放出954.6kJ热量
(1)1s22s22p63s23p4 (1分)
(2)HNO3、NH3·H2O 、NH4NO3 (3分) 平面三角形 (2分) sp2 (1分)
(3)O>S或S<O (1分) N>O 或O<N (1分)
(4)①断裂第一个π键消耗能量:CO 273kJ·mol-1< N2 523.3kJ·mol-1,CO中第一个π键更容易断裂,故CO比N2活泼 (3分) ② B、D (3分)
题目分析:原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,则X为氢元素;Y、Z左右相邻,Z、W位于同主族,原子序数Y<Z<W,则三者的相对位置为 ,令Y的原子序数为a,则Z的原子序数为a+1,W的原子序数为a+9,所以a+a+1+a+9=32-1,解得a=7,故X为氢元素,Y为氮元素,Z为氧元素,W为硫元素。
,令Y的原子序数为a,则Z的原子序数为a+1,W的原子序数为a+9,所以a+a+1+a+9=32-1,解得a=7,故X为氢元素,Y为氮元素,Z为氧元素,W为硫元素。
(1)W为S元素,S原子的电子排布式为: 1s22s22p63s23p4 。
(2)H、N、O三种元素组成的三种常见物质,分别属于酸、碱、盐,为HNO3、NH3·H2O 、NH4NO3;NO3‾中N原子作为中心原子提供5个电子,当第VIA族的元素O作为周围原子时,不提供电子,NO3‾有一个负电荷,多1个电子,所以价电子一共6个,即3对。所以没有孤对电子,空间构型为平面三角形,中心原子杂化方式为sp2。
(3)O、S元素位于同主族,电负性O>S;第一电离能N>O。
(4)①CO断裂第一个π键消耗能量为1071.9kJ•mol‾1-798.9kJ•mol‾1=273kJ·mol-1, N2断裂第一个π键消耗能量为941.7 kJ•mol‾1-418.4kJ•mol‾1=523.3kJ·mol-1,CO中第一个π键更容易断裂,故CO比N2活泼。
②A、N4为单质,错误;B、N4与N2是N元素组成的结构和性质不同的单质,互为同素异形体,正确;C、N4与P4为结构相似的分子晶体,相对分子质量越大,范德华力越大,所以沸点N4<P4,错误;D、1 mol N4气体转变为N2放出的热量为:2mol×941.7kJ•mol‾1-6mol×154.8kJ•mol‾1=954.6kJ。
