问题
填空题
下图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。
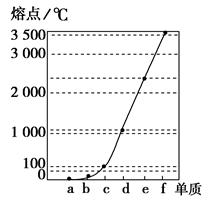
(1)请写出上图中d单质对应元素原子的电子排布式_________________________。
(2)单质a、b、f对应的元素以原子个数比1∶1∶1形成的分子中含__________个σ键,__________个π键。
(3)a与b的元素形成的10电子中性分子X的空间构型为__________;将X溶于水后的溶液滴入到含d元素高价离子的溶液中至过量,生成的含d元素离子的化学式为____________,其中X与d的高价离子之间以____________键结合。
(4)上述六种元素中的一种元素形成的含氧酸的结构为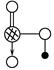 ,请简要说明该物质易溶于水的原因________________________________。
,请简要说明该物质易溶于水的原因________________________________。
答案
(1)1s22s22p63s23p63d104s1
(2)2 2
(3)三角锥形 [Cu(NH3)4]2+ 配位
(4)HNO3是极性分子,易溶于极性的水中;HNO3分子中的—OH易与水分子之间形成氢键
c,d一个为Na,一个为Cu,a,b一个为H2,一个为N2,e、f一个
为Si,一个为C。再根据熔、沸点的大小,可判断:a:H2,b:N2,c:Na,
d:Cu,e:Si,f:C。
