硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得。已知:Na2S2O3在酸性溶液中不能稳定存在。
(1)某研究小组设计了制备Na2S2O3·5H2O装置和部分操作步骤如下。

I.打开K1,关闭K2,向圆底烧瓶中加入足量浓硫酸,加热。
II.C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。当C中溶液的pH接近7时即停止C中的反应,停止加热。
III.过滤C中的混合液。
IV.将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品。
①I中,圆底烧瓶中发生反应的化学方程式是_____________________。
②II中,“当C中溶液的pH接近7时即停止C中的反应”的原因是________________。“停止C中的反应”的操作是_____________________。
③III中,“过滤”用到的玻璃仪器是________________________(填仪器名称)。
④装置B中盛放的试剂是______________(填化学式)溶液,其作用是_______________________。
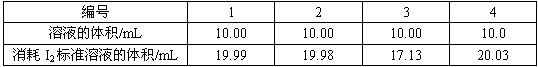
(2)依据反应2S2O32-+I2=S4O62-+2I-,可用I2的标准溶液测定产品的纯度。取5.5g产品,配制成100mL溶液。取10mL溶液,以淀粉溶液为指示剂,用浓度为0.050mol/LI2的标准溶液进行滴定,相关数据记录如下表所示。
①判断达到滴定终点的现象是__________________________。
②Na2S2O3·5H2O在产品中的质量分数是_____________________(计算结果保留1位小数)。
(Na2S2O3·5H2O的式量为248)
(1)①Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O
②Na2S2O3在酸性溶液中不能稳定存在;打开K2,关闭K1
③漏斗、玻璃棒、烧杯
④NaOH;在C中的反应停止后,吸收A中产生的多余SO2,防止空气污染
(2)①加入最后一滴I2标准溶液后,溶液变蓝,且半分钟内颜色不改变
②90.2%
