问题
实验题
某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用其产物进一步制取FeCl3·6H2O晶体(图中夹持及尾气处理装置均已略去)。
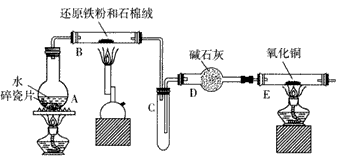
(1)装置B中发生反应的化学方程式为____ 。
(2)装置E中的现象是____ 。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,将滤液分成两份,分别检验滤液中的金属阳离子。检验Fe3+所用的试剂为___ 检验Fe2+所用的试剂为___。
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下
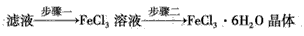
①步骤一中通入足量Cl2发生反应的离子方程式为___。
②步骤二从FeCl3溶液中得到FeCl3·6H2O晶体的主要操作如下(均在HCl气氛中进行): 蒸发、浓缩→冷却、结晶→过滤、洗涤、干燥 在蒸发皿中进行蒸发、浓缩操作时,当____时,应停止加热。此过程应保持盐酸过量的原因是___(用离子方程式表示)。
(5) FeCl3溶液可用于天然气脱硫,写出FeCl3溶液与天然气中的H2S反应的离子方程式:____。
答案
(1)3Fe +4H2O(g) Fe3O4+4H2
Fe3O4+4H2
(2)黑色粉末变为红色(试管右侧靠近出气口处有水珠)
(3)KSCN溶液;酸性KMnO4溶液
(4)①2Fe2++Cl2==2Fe3++2Cl- ;②出现少量晶体或晶膜; Fe3+ +3H2O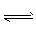 Fe(OH)3 +3H+
Fe(OH)3 +3H+
(5)2Fe3+ +H2S ==2Fe2+ +S↓+2H+
