硫酸铜是一种用途广泛的化工原料。将适量稀硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶,得到硫酸铜晶体(装置如图所示)。
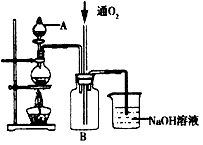
(1)图中烧瓶内发生的离子反应方程式为:______________________。
(2)反应时B瓶内的现象是___________________。
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法把Fe2(SO4)3
(作催化剂)加入到铜粉与稀硫酸的混合物中,并通入空气或氧气,即发生反应。反应完全后向其中加入物质甲调节pH,产生Fe(OH)3沉淀,过滤、蒸发、结晶,得到硫酸铜晶体,滤渣作催化剂循环使用。 经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下

请回答下列问题:
①物质甲是___(填字母序号)。
a. NH3·H2O b.CuCO3 c.NaOH d.CuO
②该方案中调节pH的范围是___。
第二组:过氧化氢氧化法将铜丝放到稀硫酸中,加入10%的H2O2,微热。充分反应后,经过滤、蒸发结晶、抽滤等操作,用少量95%的酒精淋洗后晾干,得到硫酸铜晶体。请回答:
③加热时温度不宜过高的原因是____,晶体采用酒精淋洗的优点是____。
(1)3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
(2)无色气体变为红棕色
(3)①bd;②3.2~4.7;③防止双氧水分解;酒精与水互溶且极易挥发,减少晶体溶解
