问题
实验题
晶体硅是一种重要的非金属材料。制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅;
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl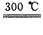 SiHCl3+H2;
SiHCl3+H2;
③SiHCl3与过量H2在1000~1100℃反应制得纯硅。已知SiHCl3能与H2O剧烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学方程式为________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点 - 84.7℃),提纯SiHCl3的方法为_________________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如图所示(热源及夹持装置均已略去):
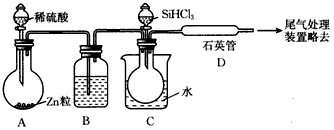
①装置B中的试剂是_______,装置C中的烧瓶需要加热,其目的是________。
②装置D中发生反应的化学方程式为_____________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及________。
答案
(1)SiO2+2C Si+2CO↑
Si+2CO↑
(2)分馏
(3)①浓硫酸;使滴入烧瓶中的SiHCl3汽化;②SiHCl3+H2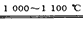 Si+3HCl;③排尽装置中的空气、保证气体的干燥
Si+3HCl;③排尽装置中的空气、保证气体的干燥
