问题
计算题
取含MnO2的软锰矿石27.86g,跟足量浓盐酸反应,制得5.6L氯气(该状态下Cl2密度为3.17g/L)计算:
(1)这种软锰矿石中MnO2的质量分数?
(2)被氧化的HCl为多少g?
答案
(1)78.1% (2)18.25
题目分析:解:(1)设该27.86g含有的MnO2的质量为x,被氧化的HCl的质量为y,根据
MnO2 + 4HCl(浓) = MnCl2 + Cl2↑
87 146 71
x y 3.17×5.6=17.752g
即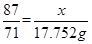 ,解得
,解得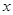 =21.752,
=21.752,
所以这种软锰矿石中MnO2的质量分数=21.752/27.86×100%="78.1%" ;
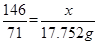 解得y=36.50g,即参加反应的HCl为36.50g,
解得y=36.50g,即参加反应的HCl为36.50g,
即被氧化的HCl=1/2×36.50=18.25g。
点评:本题考查了化学反应方程式的简单计算,该题难度适中,但是要注意5.6L的氯气并不是在标准状况下的。
