实验室可用以下装置制备乙酸乙酯(铁架台等夹持装置已略去)
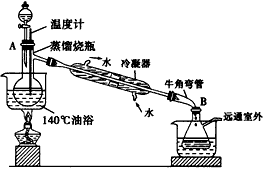
实验使用的药品如下:
冰醋酸14.3 mL(约0.25 mol)、95% 乙醇23 mL(0.37 mol)、浓H2SO4、饱和Na2CO3溶液、饱和CaCl2溶液。(CaCl2易跟乙醇生成CaCl2·6CH3CH2OH;140℃时,乙醇会发生分子间脱水生成易燃的乙醚的反应)
实验过程:主要是将各种装置连接好并检查气密性后,根据以下步骤进行:
①在蒸馏烧瓶里注入少量乙醇和所需的全部浓H2SO4并混合均匀,在分液漏斗里加入剩余的乙醇和全部冰醋酸并混合均匀;
②用油浴加热,温度保持在130~ 140℃;
③将分液漏斗内液体缓慢滴人蒸馏烧瓶,调节滴入液体的速率,使之与馏出酯的滴液速率大致相同,直到加料完毕;
④温度保持一段时间直到没有液体馏出,停止加热;
⑤取下吸滤瓶B,将饱和Na2CO3溶液分批分次加到馏出液里,边加边振荡至没有气泡产生时为止;
⑥将B中液体倒在另一分液漏斗中分液,弃去水层;
⑦在分液漏斗油层中加入饱和CaCl2溶液,振荡后静置,分层分液,弃去水层。油层为粗制乙酸乙酯。 试回答:
(1)配料时为何先加乙醇后加浓H2SO4__________________;浓H2SO4的作用是________________。
(2)配料中的乙醇和乙酸未按物质的量比1:1的理由是_____________________
(3)操作③使加料与馏出液速率大致相等的理由是______________________
(4)用饱和Na2CO3溶液洗涤酯的主要目的是__________________;用饱和CaCl2溶液洗涤酯的目的是
______________________。
(5)如果同时用Na2CO3与CaCl2两种饱和溶液洗涤酯,会出现的情况是____________________。
(6)在粗酯中还含有的主要有机物是__________________,产生它的原因是___________________。
(7)实验时B瓶支管接有长导管通向室外的理由是______________________
(1)为防止混合时产生大量的热导致液体飞溅事故;催化剂、吸水剂
(2)使乙醇过量,增大反应物浓度,使平衡向正反应方向移动,提高乙酸的转化率和补充生成乙醚时消耗的乙醇
(3)降低酯蒸气浓度,使平衡向生成酯的方向移动
(4)除去乙酸乙酯中的乙酸和部分乙醇蒸气,降低乙酸乙酯的溶解度;除去乙酸乙酯中的乙醇
(5)两种溶液将发生反应生成NaCl和CaCO3沉淀,达不到除去酯中乙酸和乙醇的目的,且CaCO3使酯呈浑浊状
(6)乙醚;在140℃时,乙醇脱水生成乙醚混入酯中
(7)把易燃的乙醚蒸气导出室外,以防遇酒精灯火焰着火而发生事故
