CuSO4·5H2O是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。
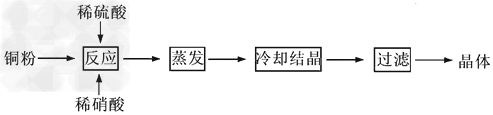
根据题意完成下列填空:
(1)理论上,为了制得纯净的CuSO4·5H2O晶体,需要消耗稀硫酸、稀硝酸溶质物质的量之比为__________,发生反应的离子方程式为____________________。
(2)为加快过滤速度,可采用__________(操作名称),该操作中洗涤沉淀时除了要注意洗涤剂的选择和用量,还应____________________
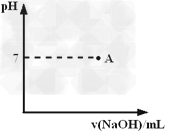
(3)实际生产过程中对所加稀硝酸的浓度控制要求比较高,通常用标准氢氧化钠溶液来滴定。滴定过程中若用酚酞作指示剂,终点现象是____________________。请在下图中画出滴定过程中溶液的pH随所滴加氢氧化钠溶液体积的变化的曲线图(要求过A点)。
(4)上述使用的标准氢氧化钠溶液已经通过基准物质的标定。下列物质中通常可用来标定碱液的基准物质是__________ 。
A.醋酸 B.草酸 C.苯甲酸 D.苯酚
(5)用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1mol Cu2(OH)2CO3后恰好恢复到电解前的浓度和pH(不考虑CO2的溶解)。则电解过程中共转移电子的物质的量为__________。
(1)3:2;3Cu +8H+ +2NO3- = 3Cu2+ + 2NO↑ +4H2O
(2)减压过滤;关小抽气泵的水龙头,让洗涤剂缓慢通过沉淀物
(3) 溶液由无色变成红色(或浅红色),且半分钟内不褪色

(4)BC
(5)0.6mol
