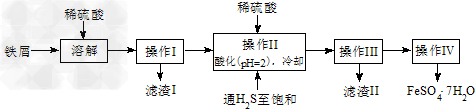
绿矾(FeSO4·7H2O)是治疗缺 铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法
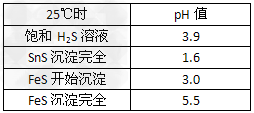
查询资料,得有关物质的数据如下表
(1)检验制得的绿矾晶体中是否含有Fe3+,最好选用的试剂为__________。
A.KSCN溶液 B.NaOH溶液 C.KMnO4溶液 D.苯酚溶液
(2)操作II中,通入硫化氢至饱和的目的是__________________;在溶液中用硫酸酸化至pH=2的目的是_______________________。
(3)操作IV的顺序依次为 ___________、冷却结晶、_____________ 。
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;②___________________________。
(5)测定绿矾产品中Fe2+含量的方法是:
a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①滴定时发生反应的离子方程式为_________________ 。
②判断此滴定实验达到终点的方法是______________________。
③计算上述样品中FeSO4·7H2O的质量分数为______________。
(1)AD
(2)除去溶液中的Sn2+离子,并防止Fe2+被氧化;防止Fe2+离子生成沉淀
(3)蒸发浓缩;过滤洗涤
(4)降低洗涤过程中FeSO4·7H2O的损耗
(5)①5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;②滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色;③0.975
