问题
实验题
实验室可用NaBr、浓H2SO4、乙醇为原料制备少量溴乙烷:C2H5-OH+HBr C2H5Br+H2O,已知反应物的用量为:0.30 mol NaBr(s)、0.25 mol C2H5OH(密度为0.80 g·cm-3)、36 mL浓H2SO4(质量分数为98%,密度为1.84 g·mL-1)、25 mL水。试回答下列问题。
C2H5Br+H2O,已知反应物的用量为:0.30 mol NaBr(s)、0.25 mol C2H5OH(密度为0.80 g·cm-3)、36 mL浓H2SO4(质量分数为98%,密度为1.84 g·mL-1)、25 mL水。试回答下列问题。
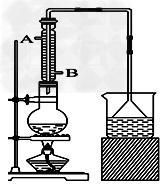
(1)该实验中漏斗的作用是什么?___________________。
(2)反应装置中的烧瓶应选择下列哪种规格最合适_______
A.50 mL B.100 mL C.150 mL D.250 mL
(3)冷凝管中的冷凝水的流向应是________
A. A进B出 B. B进A出 C. 从A进或B进均可
(4)实验完成后,须将烧瓶内的有机物蒸出,结果得到棕黄色的粗溴乙烷,欲得纯净溴乙烷,应采用的措施是用_______洗涤后分液。
A、浓NaOH溶液 B、Na2SO3溶液 C、CCl4 D、水
(5)实验员老师建议把上述装置中的仪器连接部分都改成标准玻璃接口,其原因是:__________________________。
答案
(1)防止倒吸,防止HBr,Br2等外逸,污染环境
(2)C
(3)B
(4)B
(5)反应会产生Br2,腐蚀橡胶
