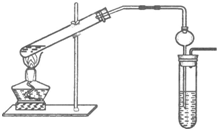
“酒是陈的香”,这是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用下图所示装置制取乙酸乙酯.
回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式:______
(2)浓硫酸的作用是:①______;③______
(3)插入右边试管的导气管上接有一个球状容器,其作用为______
(4)将接收液与乙酸乙酯分离的方法是______
(5)做此实验时,有时还向作反应容器的试管里加入几块碎瓷片,其目的是______
(6)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态.下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有______(填序号)
①单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
②单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
③混合物中各物质的物质的量相等.
(1)乙酸乙酯制取的反应方程式是:CH3COOH+CH3CH2OH
CH3COOC2H5+H2O,浓硫酸 △
故答案是:CH3COOH+CH3CH2OH
CH3COOC2H5+H2O;浓硫酸 △
(2)、反应中,浓硫酸脱去乙酸中的羟基和乙醇中的氢氧根生成水,同时起到催化作用,故答案是:
①脱水剂,②催化剂;
(3)、乙酸乙酯制备试管受热不均,导管伸入液面下可能发生倒吸,
故答案是:防止吸收液倒吸入试管;
(4)、由于乙酸乙酯不溶于水,可以采用分液方法分离,
故答案是:分液;
(5)、在给液体加热时,加入 碎瓷片可以防止暴沸,
故答案是:防止暴沸;
(6)、处于平衡状态时,同种物质的消耗和生成的相等,各种成分的物质的量不再发生变化,
①单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸,生成1mol乙酸乙酯时,同时消耗了1mol乙酸,所以达到了平衡状态,故①正确;
②无法判断是否达到平衡,故②错误;
③各个物质的物质的量大小无法判断是否平衡,关键看是否发生变化,故③错误.
本题答案的:①.
