问题
选择题
某同学从定量角度研究双氧水制取氧气的过程,在原实验基础上增加了称量操作,具体做法是:取10%的双氧水和少量的二氧化锰放入气体发生装置,并对反应前后混合物的质量进行称量,记录如下:
| 反应过程 | 反应前 | 反应后 |
| 质量变化(不含容器质量) | 34.3g | 32.7g |
若反应后,双氧水分解完全且氧气全部逸出,下列结论不正确的是( )
A.二氧化锰的质量为0.3g
B.最多得到氧气的质量为1.6g
C.双氧水中过氧化氢的质量为3.4g
D.反应后容器中水的质量为1.8g
答案
答案:D
题目分析:生成氧气的质量为:34.3g﹣32.7g=1.6g
设生成1.6g氧气需要过氧化氢的质量为x
2H2O2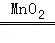 2H2O+O2↑
2H2O+O2↑
68 32
x 1.6g
根据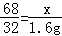 解得x=3.4g
解得x=3.4g
A、过氧化氢溶液的质量为:3.4g÷10%=34g,二氧化锰的质量为:34.3g﹣34g=0.3g,故A说法正确;
B、根据质量守恒定律,反应前物质的质量总和等于反应后物质的质量总和,生成氧气的质量
为:34.3g﹣32.7g=1.6g,故B说法正确;
C、由上面的计算可知双氧水中过氧化氢的质量为3.4g,故C说法正确,
D、反应后容器中水的质量为:32.7g﹣0.3g=32.4g,故D说法错误.
