Ⅰ.2011年4月27日某市工商局查获400克袋装中老年补钙营养奶粉1 401包。这种奶粉被鉴定为所含亚硝酸盐残留量高出正常值7.8倍,长期食用可能致癌。已知NaNO2能发生如下反应:2NaNO2+4HI===2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是_____,若有0.75 mol的还原剂被氧化,则被还原的氧化剂有_____mol。
(2)根据上述反应,可以用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有:①自来水;②淀粉碘化钾试纸;③淀粉;④白糖;⑤食醋;⑥白酒。进行实验时,必须选用的物质有____________。
(3)某工厂废切削液中含有2%~5%的NaNO2,直接排放会造成污染,下列试剂中_____(填序号)能使NaNO2转化为不引起二次污染的N2反应的化学方程式为________________________ (并标出电子转移的数目和方向)。
①NaCl ②NH4Cl ③H2O2 ④浓H2SO4
(4)下列离子在溶液中一定能大量共存的是________。
A.NH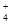 Cl- OH- CO
Cl- OH- CO
B.Fe2+ NO3- Cl- H+
C.CH3COO- NH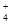 H+ Cl-
H+ Cl-
D.CH3COO- Na+ Cl- SO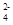 Ⅱ.实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应式为
Ⅱ.实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应式为
4CuI+Hg===Cu2HgI4+2Cu。
(1)上述反应产物Cu2HgI4中,Cu元素是________价。
(2) CuI可由Cu2+与I-直接反应制得,请配平下列反应的离子方程式:
 Cu2++
Cu2++ I-===
I-=== CuI+
CuI+ I
I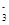
Ⅰ(1)NaNO2 0.75 (2)②⑤
(3)② (4)D
(4)D
Ⅱ.(1)+1 (2) 2Cu2++5I-===2CuI+I3-
题目分析:Ⅰ(1)根据反应的方程式可知,亚硝酸钠中氮元素的化合价从+3价降低到+2价,得到1个电子,所以亚硝酸钠是还原剂。HI中I元素的化合价从-1价升高到0价,失去1个电子,则根据电子得失守恒可知,若有0.75 mol的还原剂被氧化,则被还原的氧化剂有0.75mol。
(2)根据反应的方程式可知,该反应是在酸性条件下进行的,所以必须选用的物质有淀粉碘化钾试纸和食醋,答案选②⑤。
(3)使NaNO2转化为不引起二次污染的N2,这说明在反应中亚硝酸钠是氧化剂,得到电子,所以选择的应该是还原剂,NH4+中的氮元素处于最低价态,具有还原性,所以选择的试剂是氯化铵,即答案选②,反应的方程式是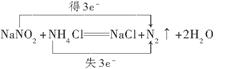 。
。
(4)A中的OH-与NH4+不能大量共存;B中溶液显酸性,则NO3-能氧化Fe2+不能大量共存;C中的CH3COO-和H+不能大量共存,所以答案选D。
Ⅱ.(1)在Cu2HgI4中,Hg显+2价,I是-1价,所以铜是+1价。
(2)在反应中铜的化合价从+2价降低到+1价,得到1个电子,而碘元素碘化合价从-1价升高到0价,失去1个电子,则根据电子的得失守恒可知,配平后的方程式应该是2Cu2++5I-===2CuI+I3-。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生解题能力的培养和方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力。该题的关键是准确标出有关元素的化合价变化情况,然后依据有关的概念,并结合电子得失守恒进行列式计算和判断即可。
