(15分)硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
⑴SO2和O2反应制取SO3的反应原理为:2SO2+O2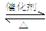 2SO3,在一密闭容器中一定时间内达到平衡.
2SO3,在一密闭容器中一定时间内达到平衡.
①该反应的平衡常数表达式为: .
②该反应达到平衡状态的标志是 .
A.v(SO2)=v(SO3) B.混合物的平均相对分子质量不变
C.混合气体质量不变 D.各组分的体积分数不变
⑵某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图,电极为多孔的材料能吸附气体,同时也能使气体与电解质溶液充分接触.

①B电极的电极反应式为 ;
②溶液中H+的移动方向由 极到 极;(用A、B表示)
⑶测定绿矾产品中含量的实验步骤:
a.称取5.7 g产品,溶解,配成250 mL溶液
b.量取25 mL待测液于锥形瓶中
c.用硫酸酸化的0.01 mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积40 mL
根据上述步骤回答下列问题:
①滴定时发生反应的离子方程式为(完成并配平离子反应方程式).
Fe2++ 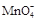 + —— Fe3++ Mn2++
+ —— Fe3++ Mn2++
②用硫酸酸化的KMnO4滴定终点的标志是 .
③计算上述产品中FeSO4·7H2O的质量分数为 .
⑴①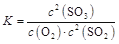 ②BD
②BD
⑵①SO2+2H2O-2e-==SO42-+4H+ ②B A
⑶①5Fe2++1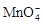 +8H+===5Fe3++1Mn2++4H2O
+8H+===5Fe3++1Mn2++4H2O
②滴定最后一滴酸性KMnO4时溶液呈淡紫色,半分钟内不褪色。 ③0.975或97.5%
题目分析:(1)①根据平衡常数的概念可知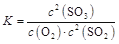 。
。
②A项没有正逆反应速率,不能判断;B项混合物的平均相对分子质量反应前后不同,可以判断;C项混合气体的质量反应前后不变,不能判断;D项各组分的体积分数反应前后不同,可以判断。答案选BD。
(2)①根据B极的产物可以看出B极发生氧化反应,是负极,电极方程式为SO2+2H2O-2e-=SO42-+4H+。
②阳离子向正极移动,所以H+从B极向A极移动。
(3)①根据化合价升降法,方程式配平为5Fe2++1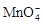 +8H+===5Fe3++1Mn2++4H2O。
+8H+===5Fe3++1Mn2++4H2O。
②KMnO4本身有颜色,所以不需要指示剂,用本身的颜色就可以判断终点,当滴定最后一滴酸性KMnO4时溶液呈淡紫色,半分钟内不褪色时达到滴定终点。
③产品中FeSO4·7H2O的质量分数为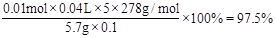 。
。
点评:本题综合性强,难度较大,非常锻炼学生的思维能力。
