在高中阶段,我们学习了两种酯的实验室制备方法:
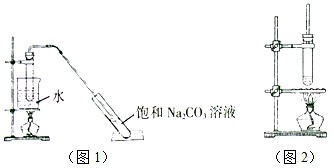
①乙酸乙酯的制备(装置如图1);
②乙酸丁酯[CH3COO(CH2)3CH3]的制备(装置如图2).
制备这两种酯所涉及的有关物质的物理性质见表:
| 物理性质 | 乙酸 | 乙醇 | 1-丁醇 | 乙酸乙酯 | 乙酸丁酯 |
| 熔点(℃) | 16.6 | -117.3 | -89.5 | -83.6 | -73.5 |
| 沸点(℃) | 117.9 | 78.5 | 117 | 77.06 | 126.3 |
| 密度(g/cm3) | 1.05 | 0.79 | 0.81 | 0.90 | 0.88 |
(1)在乙酸乙酯的制备过程中,采用水浴加热的优点为______;制备乙酸丁酯的过程中,直玻璃管的作用是______,试管不与石棉网直接接触的原因是______.
(2)乙酸乙酯制备时,饱和Na2CO3溶液的作用是______.两种酯的提纯过程中都需用到的关键仪器是______,在操作时要充分振荡、静置,待液体分层后先将水溶液放出,最后将所制得的酯从该仪器的______(填序号).
A.上口倒出 B.下部流出 C.都可以
(3)在乙酸丁酯制备中,下列方法可提高1-丁醇的利用率的是______(填序号).
A.使用催化剂 B.加过量乙酸 C.不断移去产物 D.缩短反应时间
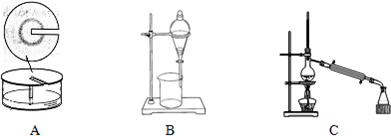
(4)1-丁醇若含有乙醇,有同学认为制得的乙酸丁酯中含有乙酸乙酯.为了证实该观点,可尝试选用下列______(填序号)装置来做实验,请简述与实验结论有关的实验过程和现象______.
(1)用水浴加热均匀受热,容易控制温度.
乙酸、丁醇加热易挥发,为减少原料的损失,直玻璃管对蒸汽进行冷凝,重新流回反应器内.
试管与石棉网直接接触受热温度高,容易使有机物分解碳化.
故答案为:均匀受热,容易控制温度,冷凝、回流;防止加热温度过高,有机物碳化分解.
(2)制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,主要是利用了乙醇与水混溶,乙酸能被碳酸钠吸收,易于除去杂质,饱和碳酸钠降低乙酸乙酯的溶解度,增大水的密度,使酯浮于水面,容易分层析出,便于分离.
分离互不相溶的液体通常分液的方法,分液利用的仪器主要是分液漏斗,使用时注意下层液从分液漏斗管放出,上层液从分液漏斗上口倒出,酯的密度比水小,应从分液漏斗上口倒出.
故答案为:除去乙酸乙酯中的乙酸和乙醇,降低乙酸乙酯的溶解度,便于分层;分液漏斗;A.
(3)提高1-丁醇的利用率,可使平衡向生成酯的方向移动.
A.使用催化剂,缩短反应时间,平衡不移动,故A错误;
B.加过量乙酸,平衡向生成酯的方向移动,1-丁醇的利用率增大,故B正确;
C.不断移去产物,平衡向生成酯的方向移动,1-丁醇的利用率增大,故C正确;
D.缩短反应时间,反应未达平衡,1-丁醇的利用率降低,故D错误.
故选:BC.
(4)由表中数据可知,乙酸丁酯与乙酸乙酯沸点相差比较大,乙酸乙酯沸点为77.06℃,可利用蒸馏原理,将制得的乙酸丁酯进行蒸馏,看能否得到78℃左右的馏分,且该馏分不溶于饱和碳酸钠溶液,若有则说明含有乙酸乙酯,没有则不含乙酸乙酯.
故答案为:将制得的乙酸丁酯进行蒸馏,看能否得到78℃左右的馏分,且该馏分不溶于饱和碳酸钠溶液.
