黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe2O3.
(1)将0.050mol SO2(g)和0.030mol O2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g)⇌2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol•L-1.计算该条件下反应的平衡常数K和SO2的平衡转化率______、______(写出计算过程).
(2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有______(填字母序号,多选倒扣分).
A.升高温度 B.降低温度 C.增大压强 D.加入催化剂 E.移出氧气
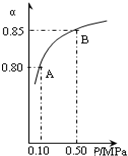
(3)某温度下,上述反应中SO2的平衡转化率(α)与体系总压强(p)的关系如右图所示.判断:平衡状态由A变到B时,平衡常数K(A)______K(B)(填“>”、“<”或“=”).
(1)2SO2(g)+O2(g)⇌2SO3(g)
起始(mol/L):0.050 0.030 0
转化(mol/L):0.040 0.020 0.040
平衡(mol/L):0.010 0.010 0.040
K=
=c2(SO3) c2(SO2)•c(O2)
=1.6×103,0.0402 0.0102×0.010
α(SO2)=
=80%,0.040 0.050×100%
故答案为:1.6×103;80%;
(2)反应放热,为提高SO2平衡转化率,应使平衡向正反应方向移动,可降低温度,体积不变,不能从压强的角度考虑,催化剂不影响平衡移动,移出氧气,平衡向逆反应方向移动,不利于提高SO2平衡转化率,
故答案为:B;
(3)平衡常数只与温度有关,与压强无关,在温度不变的条件下,无论压强怎样变化,平衡常数都不变,故答案为:=.