问题
填空题
已知下列两个反应①Fe+H2SO4(稀)=FeSO4+H2↑
②Cu+2H2SO4(浓)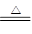 CuSO4+SO2↑+2H2O。试回答下列问题:
CuSO4+SO2↑+2H2O。试回答下列问题:
(1)反应①中 元素被还原,反应②中 元素被还原.
(2)当反应①生成2gH2时,消耗H2SO4的物质的量是 。
(3)反应②若有1mol H2SO4作氧化剂时,转移电子的物质的量为 ,若有4mol H2SO4参加反应时,被还原元素的质量是 g。
答案
(共8分)(1)H 、S(各1分) (2)1mol (3)2mol 、64g(每空2分)
题目分析:(1)反应①中硫酸中氢元素的化合价解得,所以H元素被还原,反应②中硫酸中S元素的化合价降低,所以S元素被还原。
(2)2g氢气的物质的量是1mol,则消耗稀硫酸的物质的量是1mol。
(3)硫酸中S元素的化合价从+6价降低到+4价,得到2个电子,所以反应②若有1mol H2SO4作氧化剂时,转移电子的物质的量为2mol。若有4mol H2SO4参加反应时,被还原的硫酸是2mol,所以被还原元素的质量是2mol×32g/mol=64g。
点评:该题是中等难度的试题,试题基础性强,侧重对学生基础知识的巩固与训练。有利于培养学生灵活运用基础知识解决实际问题的能力,提高学生的应试能力。该题的关键是明确氧化还原反应有关概念,准确标出有关元素的化合价变化情况,然后根据电子得失守恒并结合题意灵活运用即可。
