计算题:
已知:pKayΘ(HCOOH)=3.75,pKayΘ(HAc)=4.75,p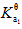 (H3PO4)=2.12;欲配制pH=3.5的缓冲溶液500mL,并使溶液中酸的浓度为0.20mol•L-1。应选用哪种缓冲对?需称取多少固体钠盐?
(H3PO4)=2.12;欲配制pH=3.5的缓冲溶液500mL,并使溶液中酸的浓度为0.20mol•L-1。应选用哪种缓冲对?需称取多少固体钠盐?
参考答案:
选取HCOOH-HCOONa为缓冲对,
因为pH=pKa-lgca/cb
3.5=3.75-lgca/cb
ca/cb=1.778有Cb=0.1125mol•L-1
m(HCOONa)=0.1125´0.5´68=3.825g
计算题:
已知:pKayΘ(HCOOH)=3.75,pKayΘ(HAc)=4.75,p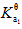 (H3PO4)=2.12;欲配制pH=3.5的缓冲溶液500mL,并使溶液中酸的浓度为0.20mol•L-1。应选用哪种缓冲对?需称取多少固体钠盐?
(H3PO4)=2.12;欲配制pH=3.5的缓冲溶液500mL,并使溶液中酸的浓度为0.20mol•L-1。应选用哪种缓冲对?需称取多少固体钠盐?
参考答案:
选取HCOOH-HCOONa为缓冲对,
因为pH=pKa-lgca/cb
3.5=3.75-lgca/cb
ca/cb=1.778有Cb=0.1125mol•L-1
m(HCOONa)=0.1125´0.5´68=3.825g