阅读下列程序,请写出该程序的输出结果。
public class A {
int m = 5;
static int n = 3;
public static void main(String[] args) {
A obj 1 = new A();
A obj2 = new A();
objl.m *= 2;
objl.n *= 4;
obj2.m += 1;
obj2.n += 6;
System.out.println("obj 1.m=’’ + obj 1.m);
System.out.println("obj 1.n=" + obj 1.n);
System.out.println("obj2.m=" + obj2.m);
System.out.println("obj2.n=" + obj2.n);
}
}
参考答案:
obj1.m=10
obj1.n=18
obj2.m=6
obj2.n=18

 2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:
2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下: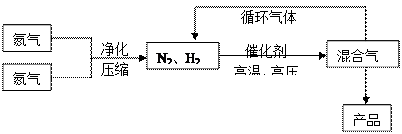
 95.79
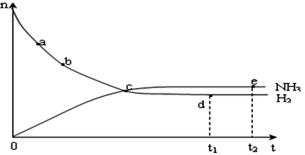
95.79 2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是