工业生产硝酸铵的流程图如下图。请回答
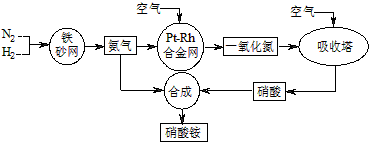
(1)已知:N2(g)+3H2(g)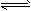 2NH3(g) ΔH=-92 kJ·mol-1。
2NH3(g) ΔH=-92 kJ·mol-1。
①在500℃、2.02×107Pa和铁催化条件下向一密闭容器中充入1molN2和3molH2,充分反应后,放出的热量______(填“<”“>”“=”)92.4kJ,理由是______________________________。
②为有效提高氢气的转化率,实际生产中宜采取的措施有____________
A.降低温度 B.最适合催化剂活性的适当高温 C.增大压强
D.降低压强 E.循环利用和不断补充氮气 F.及时移出氨
(2) 已知铂铑合金网未预热也会发热。写出氨催化氧化的化学方程式:________________________,该反应的化学平衡常数表达式K=________________,当温度升高时,K值______(填“增大”、“减小”或“无影响”)。
(3)在一定温度和压强的密闭容器中,将平均相对分子质量为8.5的H2和N2混合,当该反应达到平衡时,测出平衡混合气的平均相对分子质量为10,请计算此时H2的转化率(写出计算过程)
___________________________________________
(1)①<;在101KPa和298K条件下,1mol氮气和3mol氢气完全反应生成2mol氨气,放出92.4kJ热量,该反应为可逆反应,反应物不能全部变为生成物;又因为反应温度为500℃,所以放出的热量小于92.4kJ
②CEF
(2)4NH3+5O2 4NO+6H2O; K=
4NO+6H2O; K=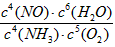 ;减小
;减小
(3)设充入气体总量为1mol,氮气的物质的量为x,则氢气的物质的量为(1-x)。
则有: 28x+2(1-x)=8.5(或用十字交叉法)
解得:N2:x=0.25mol H2:1mol-0.25mol=0.75mol
又设平衡时N2转化的物质的量为y,则
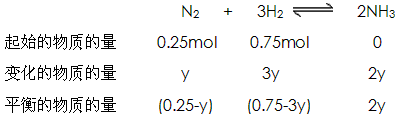
则有:
解得:y=0.075mol
则氢气的转化率为:
