(1)请完成该反应的离子方程式:
C + MnO4- + H+ — CO2↑+ Mn2+ + H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中。进行反应CO(g ) + H2O(g)  CO2(g) + H2(g)得到如下两组数据:
CO2(g) + H2(g)得到如下两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
①实验1从开始到达到化学平衡时,以v(CO2)表示的反应速率为 。(精确到0.01)
②该反应为 (填“吸”或“放”)热反应,实验2中达平衡时 CO的转化率为 。
(3)在容积可变的密闭容器中发生反应:mA(g) + nB(g)  pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol·L-1 | 0.08 | 0.20 | 0.44 |
①当压强从2×105 Pa增加到5×105 Pa时,平衡 移动(填:向左, 向右 ,不)
②当压强从5×105 Pa增加到1×106 Pa时,该反应平衡常数表达式为K= 。⑷在25℃下,向浓度为0.1mol·L-1的FeCl3溶液中逐滴加入氨水,调节溶液pH为 5时,溶液中c(Fe3+)为 mol/L 。(已知25℃时 Ksp[Fe(OH)3]=4×10-38)
(1)①5 C + 4 MnO4- + 12 H+ = 5 CO2↑+ 4 Mn2+ + 6 H2O
(2)①0.13 mol·L-1 ·min-1; ②放 ; 20%
(3)①不; ②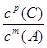 .
.
(4)4×10-11
题目分析:(1)①反应中MnO4-→Mn2+,锰元素化合价由+7价降低为+2价,共降低5价,C→CO2,碳元素化合价由0价升高为+4,共升高4价,化合价最小公倍数为20,故MnO4-系数为4,C系数为5,再根据元素守恒可知Mn2+系数为4、CO2系数为5,根据电荷守恒可知H+系数为12,根据氢元素守恒可知H2O系数为6,配平后离子方程式为5 C + 4 MnO4- + 12 H+ ="=" 5 CO2↑+ 4 Mn2+ + 6 H2O,答案:5 C + 4 MnO4- + 12 H+ ="=" 5 CO2↑+ 4 Mn2+ + 6 H2O。
(2)①、由表中数据可知,CO的物质的量变化量为4mol-2.4mol=1.6mol,v(CO)=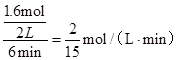 ,速率之比等于化学计量数之比,故v(CO2)=v(CO)=
,速率之比等于化学计量数之比,故v(CO2)=v(CO)=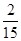 mol/(L·min)=0.13mol/(L·min),
mol/(L·min)=0.13mol/(L·min),
故答案为:0.13mol/(L·min);
②、实验1中CO的转化率为×100%=40%,实验2中CO的转化率为×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,正反应放热,
故答案为:放热;
平衡时CO的物质的量为1.6mol,则:
CO(g)+H2O(g) CO2(g)+H2(g),
CO2(g)+H2(g),
开始(mol):2 1 0 0
变化(mol):0.4 0.4 0.4 0.4
平衡(mol):1.6 0.6 0.4 0.4
实验2中达平衡时 CO的转化率为 ×100%=20%
×100%=20%
答案:①0.13 mol·L-1 ·min-1; ② 放 ; 20%
(3) ①压强从2×105Pa增加到5×105 Pa时,A的浓度应变化为0.08mol·L-1的2.5倍即为0.20mol·L-1,而图表中变化为0.20mol·L-1,说明平衡不移动,加压时生成物A浓度增大的倍数等于压强增大的倍数;
②压强从2×105 Pa 增加到1×106 Pa时,A的浓度应变化为0.08mol·L-1的5倍即0.40mol·L-1,而图表中A的浓度为0.44mol·L-1,说明平衡逆向进行;根据①可知反应是气体体积增大的反应,所以此时B加压变为液体或固体,当压强从5×105 Pa增加到1×106 Pa时,该反应平衡常数表达式为K=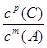
故答案为:①不; ② 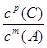 .
.
(4 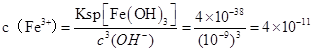 ,答案:4×10-11
,答案:4×10-11
