问题
填空题
氯化硫酰(SO2Cl2)主要用作氯化剂。它是一种无色液体,熔点- 54.1℃,沸点 69.1℃,遇水生成硫酸和氯化氢。氯化硫酰可用干燥的二氧化硫和氯气在活性炭的催化下反应制取:
SO2(g)+ Cl2(g) 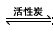 SO2Cl2(l) △H = -97.3 kJ . mol-1
SO2Cl2(l) △H = -97.3 kJ . mol-1
(1)为了提高上述反应中Cl2的转化率,下列措施合理的是___(填编号)。
A.缩小容器体积
B.使用催化剂
C.增加SO2的浓度
D.升高温度
(2)已知20℃时,AgCl的溶解度为0.000 15 g,Ag2SO4的溶解度为0.796 g。则向SO2Cl2溶于水所得溶液中逐滴加入稀AgNO3溶液时,最先产生的沉淀是___。
(3)300℃时,体积为1 L的密闭容器中充入16. 20 g SO2Cl2,达到平衡时,容器中含7.616 g SO2,则300℃时合成SO2Cl2反应的平衡常数为___。
(4)将(3)所得的平衡混合气溶于足量的BaCl2溶液中,计算最终生成沉淀的质量(写出计算过程)。____________________
答案
(1)AC
(2)AgCl
(3)0. 0706
(4)SO2Cl2+2H2O==H2SO4 +2HCl
SO2+Cl2+2H2O==H2SO4+2HCl
H2SO4 +BaCl2 =BaSO4↓+2HCl
由S元素质量守恒,可得:BaSO4的物质的量为0.12 mol,
质量为 0.12 mol×233 g.mol-1=27.96 g
