373K时,某1L密闭容器中加入1molPCl5发生如下可逆反应:
PCl5 (g)

PCl3(g)+Cl2 (g).其中物质PCl3的物质的量变化如右图所示.
(1)前20s内PCl5(g)的平均反应速率为______
(2)373K时该反应的平衡常数的值为______
(3)若在此平衡体系中再加入1mol的PCl5,与原平衡比较,新平衡时PCl5的转化率______(填“增大”或“减小”,下同).PCl5的平衡浓度______
(4)将原平衡升温至473K,重新达平衡时(其他条件不变),PCl3的平衡浓度为PCl5的3倍,该反应的正反应为______(填“放热反应”或“吸热反应”),为增大平衡体系中Cl2的物质的量,下列措施正确的是(其它条件相同)______
a.升高温度 b.扩大容器的体积
c.加入合适的催化剂 d.再充入PCl3.
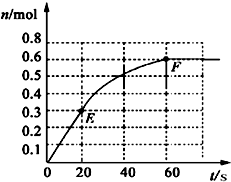
(1)由图象可知20s时,生成的PCl3的物质的量为0.3mol,所以前20s内,PCl3(g)的平均反应速率为
v(PCl3)=
=△n(PCl3) V △t
=0.015mol•L-1•s-1,反应速率之比等于化学计量数之比,所以v(PCl5)=v(PCl3)=0.015mol•L-1•s-1.0.3mol 1L 20s
故答案为:0.015mol•L-1•s-1;
(2)由图象可知60s时,反应达平衡,平衡时生成的PCl3的物质的量为0.6mol,
利用三段式解题法,求出平衡时混合物各组分的物质的量
PCl5 (g)

PCl3(g)+Cl2 (g),
开始(mol):1 0 0
变化(mol):0.6 0.6 0.6
平衡(mol):0.4 0.6 0.6
所以k=
=c(PCl3)c(Cl2) c(PCl5)
=0.9mol•L-1,0.6×0.6 0.4
故答案为:0.9mol•L-1;
(3)平衡体系中再加入1mol的PCl5,重新到达平衡状态,可以等效为开始加入2mol的PCl5,体积增大为原来的2倍,达平衡(该平衡与原平衡等效)后再将体积压缩到原来大小,与原平衡相比,积压缩压强增大平衡状态,平衡向体积减小的方向移动,即向逆反应方向移动,转化率减小,移动结果降低浓度增大趋势,平衡时浓度仍然高于原平衡,故新平衡时PCl5的转化率减小,浓度增大.
故答案为:减小;增大;
(4)由(2)可知,373K时该反应达平衡时,PCl3的平衡浓度为PCl5的1.5倍,而升温至473K重新达平衡时(其他条件不变),PCl3的平衡浓度为PCl5的3倍,倍数增加,说明平衡向正反应移动,升高温度平衡向吸热反应移动,故该反应正反应为吸热反应.
增大平衡体系中Cl2的物质的量,平衡应向正反应移动.
a、正反应为吸热反应,升高温度,平衡向正反应移动,Cl2的物质的量增大,故a正确;
b、扩大容器的体积、压强降低,平衡向体积增大方向移动,即向正反应移动,Cl2的物质的量增大,故b正确;
c、加入合适的催化剂,缩短达到平衡的时间,平衡不移动,Cl2的物质的量不变,故c错误;
d、再充入PCl3,平衡向逆反应移动,Cl2的物质的量减小,故d错误;
则ab措施正确,故答案为:吸热反应;ab.
