问题
选择题
汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑。则列判断正确的是
A.反应中KNO3为还原剂
B.NaN3中氮元素为-3价
C.标准状况下,若有6.5gNaN3参加反应,则生成3.584L N2
D.若1mol KNO,参加反应,转移电子的物质的量为10mol
答案
答案:C
题目分析:A、根据方程式可知硝酸钾中氮元素的化合价从+5价降低到0价得到电子,因此硝酸钾是氧化剂,A不正确;B、钠在化合物中显+1价,因此氮化钠中氮元素的化合价是-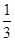 价,B不正确;C、6.5g氮化钠的物质的量是6.5g÷65g/mool=0.1mol,根据方程式可知反应中生成氮气的物质的量是0.16mol,则标准状况下氮气的体积是0.16mol×22.4L/mol=3.584L,C正确;D、硝酸钾中氮元素的化合价+5价降低0价,得到5个电子,因此若1mol KNO,参加反应,转移电子的物质的量为5mol,D不正确,答案选C。
价,B不正确;C、6.5g氮化钠的物质的量是6.5g÷65g/mool=0.1mol,根据方程式可知反应中生成氮气的物质的量是0.16mol,则标准状况下氮气的体积是0.16mol×22.4L/mol=3.584L,C正确;D、硝酸钾中氮元素的化合价+5价降低0价,得到5个电子,因此若1mol KNO,参加反应,转移电子的物质的量为5mol,D不正确,答案选C。
