运用化学反应原理研究以下问题:
(1)合成氨反应N2(g)+3H2(g)

2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡______移动(填“向左”、“向右”或“不”),平衡常数K______(填“变大”、“变小”或“不变”);使用催化剂______反应的△H(填“增大”、“减小”或“不改变”).
(2)在25℃时,向浓度均为0.1mol•L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成______沉淀(填化学式),生成该沉淀的离子方程式为______.(已知25°CKsp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20)
(3)在25℃时,将a mol•L-1的氨水与0.01mol•L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显______性(填“酸”、“碱”或“中”);且a______0.01(填“>”、“=”或“<”).
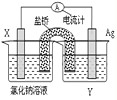
(4)依据反应:Cu2+(aq)+Fe(s)═Fe2+(aq)+Cu(s) 设计的原电池如图所示:
电极X的材料是______;电解质溶液Y是______;若Y为氯化钠溶液,则经过一段时间,发现X极上出现锈斑,则此过程中正极的电极反应式为______.
(1)恒温、恒压条件下向平恒体系中通入氩气,则反应体系体积增大,相当于压强减小,则平衡向气体体积增大的方向移动,即左移;
化学平衡常数只与温度有关,温度不变,化学平衡常数不变;
因使用催化剂只是改变了反应的途径,没有改变反应物与生成物的状态,则△H不变;
故答案为:向左;不变;不改变;
(2)由于KsP[Cu(OH)2]=2.2×10-20<Ksp[Mg(OH)2]=1.8×10-11,所以Cu(OH)2先生成沉淀;一水合氨和铜离子反应生成氢氧化铜和氨根离子,所以离子方程式为
2NH3•H2O+Cu2+=Cu(OH)2↓+2 NH4+,故答案为:Cu(OH)2;2NH3•H2O+Cu2+=Cu(OH)2↓+2 NH4+;
(3)根据溶液的电中性原则,c(NH4+)=c(Cl-),则c(H+)=c(OH-),则溶液显中性;
因体积、浓度相同的稀盐酸和氨水混合,溶液中的溶质为氯化铵,溶液呈酸性,若该溶液恰好呈中性,氨水应稍微过量,所以氨水的浓度大于盐酸的浓度.
故答案为:中;>;
(4)由反应“Cu2+(aq)+Fe(s)═Fe2+(aq)+Cu(s)”可知,在反应中,铁被氧化,失电子,应为原电池的负极,Cu2+在正极上得电子被还原,电解质溶液为含有铜离子的溶液,硫酸铜溶液或氯化铜溶液等;在弱酸性或中性溶液中,铁容易发生吸氧腐蚀,氯化钠溶液呈中性,所以铁在氯化钠溶液中易腐蚀吸氧腐蚀,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+2H2O+4e-═4OH-.
故答案为:Fe;硫酸铜溶液或氯化铜溶液等;O2+2H2O+4e-═4OH-.
