在常温下,一氯甲烷是无色气体,密度为0.9159g/cm3,熔点-97.73℃,沸点为-24.2℃;18℃时它在水中的溶解度为280mL/L水,它与乙醚、丙酮或苯互溶,能溶于乙醇。在实验室可用图所示装置制造一氯甲烷。
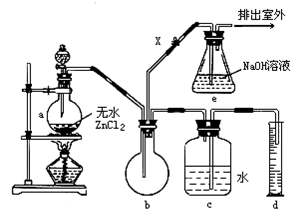
制备装置的分液漏斗和烧瓶中分别盛有甲醇和浓盐酸,试填写下列空白.
(1)制备一氯甲烷的化学方程式为 ;其反应类型是
(2)装置b的作用是_ ___
(3)检验气体产物CH3Cl的方法是:在e的逸出口点燃CH3Cl气体,火焰呈蓝绿色(与其他烃燃烧现象有明显区别),CH3Cl燃烧的化学方程式为__ __
(4)实验中实际按甲醇和浓盐酸1∶2(物质的量之比)进行反应的理由是___ _
(5)某学生在关闭活塞X的情况下做此实验时,发现收集到一定体积的气体产物所消耗的甲醇—浓盐酸的混合液的量比正常情况下多(装置的气密性没有问题),其原因是____
(6)实验结束时,d中收集到的液体中含有_
(1)CH3Cl+HCl →CH3Cl+HCl,取代。(2)防止倒吸、保证安全。
(3)2CH3Cl+3O2→ 2CO2+2H2O+2HCl。(4)可使甲醇充分反应,转化成一氯甲烷。
(5)甲醇沸点较低(64.7℃),受热时易挥发,致使一部分未反应而逸出。
(6)甲醇、盐酸、一氯甲烷。
分析题目所给氯乙烷的性质和所学乙醇与HX的反应分析、判断。
(1) 制备一氯甲烷的化学方程式为:CH3Cl+HCl →CH3Cl+HCl,其反应类型是取代反应。
(2) 装置b的作用是防倒吸。
(3) CH3Cl燃烧的化学方程式为:2CH3Cl+3O2→ 2CO2+2H2O+2HCl
(4) 实验中实际按甲醇和浓盐酸1∶2(物质的量之比)进行反应的理由是: 可使甲醇充分反应,转化成一氯甲烷。
(5) 其原因是: 甲醇沸点较低(64.7℃),受热时易挥发,致使一部分未反应而逸出
(6) 实验结束时,d中收集到的液体中含有甲醇、盐酸、一氯甲烷
