(2008年天津卷,理综,28)Ⅰ.化学实验室制取氯化氢气体的方法之一是将浓硫酸滴入浓盐酸中。请从下图中挑选所需仪器,在方框内画出用该方法制备、收集干燥氯化氢气体的装置简图,并在图中标明所用试剂。(仪器可重复使用,固定装置不必画出)。
(1)写出该实验制备硫酸亚铁的化学方程式:__ __。
(2)硫酸溶液过稀会导致__ __。
(3)采用水浴加热的原因是__ __。
(4)反应时铁屑过量的目的是(用离子方程式表示)__ __。
(5)溶液趁热过滤的原因是__ _。塞紧试管口的目的是___ _。
(6)静置冷却一段时间后,在试管中观察到的现象是_ ___。
(1)Fe+H2SO4(稀)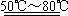 =FeSO4+H2↑;装置图见解析;(2)反应速率慢;不利于晶体析出;(3)(4)Fe3++2Fe=3Fe2+;(5)减少FeSO4的损失;防止空气进入试管将Fe2+氧化为Fe3+;(6)有浅绿色晶体析出。
=FeSO4+H2↑;装置图见解析;(2)反应速率慢;不利于晶体析出;(3)(4)Fe3++2Fe=3Fe2+;(5)减少FeSO4的损失;防止空气进入试管将Fe2+氧化为Fe3+;(6)有浅绿色晶体析出。
Ⅰ.浓硫酸和浓盐酸反应制取HCl气体,不需要加热,即:液+液→气,可采用分液漏斗和圆底烧瓶组成发生装置;干燥HCl可以装有浓硫酸的洗瓶,收集HCl用向上排空气法,由于HCl气体极易溶于水,故在水面用倒扣的漏斗来吸收尾气。整个装置为: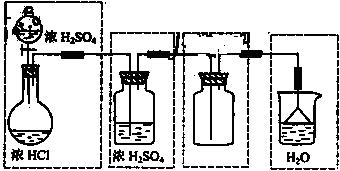
Ⅱ.⑴铁和稀硫酸反应的方程式为:Fe+H2SO4(稀)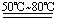 FeSO4+H2↑。(2)硫酸如果浓度过稀,则反应时速率过慢;另外由于溶液中含有较多的水,也不利于硫酸亚铁晶体的析出。(3)水浴加热受热均匀,温度容易控制。(4)铁屑过量的目的是防止Fe2+被氧化成Fe3+,即使被氧化Fe可以使Fe3+还原:Fe+2Fe3+=3Fe2+。(5)溶液趁热过滤的目的是减少FeSO4的损失;塞紧试管口的目的是防止空气中的氧气将FeSO4氧化。(6)硫酸亚铁热溶液在冷却过程中,溶解度降低,在静止冷却一段时间后会有浅绿色硫酸亚铁晶体析出。
FeSO4+H2↑。(2)硫酸如果浓度过稀,则反应时速率过慢;另外由于溶液中含有较多的水,也不利于硫酸亚铁晶体的析出。(3)水浴加热受热均匀,温度容易控制。(4)铁屑过量的目的是防止Fe2+被氧化成Fe3+,即使被氧化Fe可以使Fe3+还原:Fe+2Fe3+=3Fe2+。(5)溶液趁热过滤的目的是减少FeSO4的损失;塞紧试管口的目的是防止空气中的氧气将FeSO4氧化。(6)硫酸亚铁热溶液在冷却过程中,溶解度降低,在静止冷却一段时间后会有浅绿色硫酸亚铁晶体析出。
