某学生要用50 mL NaOH溶液和CO2来制取纯Na2CO3溶液,已知CO2气体在通入NaOH溶液过程中极易生成NaHCO3,且无明显现象。
实验室有下列试剂:①未知浓度的NaOH溶液 ②37%的盐酸 ③37%的硫酸 ④14%的盐酸 ⑤大理石⑥饱和NaHCO3溶液
实验室有下列仪器:量筒,烧杯,橡皮管,玻璃导管,分液漏斗,烧杯,洗气瓶,酒精灯。
已知下表中各物质在常温时的溶解度(g/100 g H2O)
| Na2CO3 | NaHCO3 | NaCl | Na2SO4 | NaHSO4 | NaOH |
| 15.9 | 8.4 | 35 | 35.5 | 20 | 40 |
小题2:实验为保证制得Na2CO3的纯度,应选用的药品,除①外,还应需要: 。
小题3:简要叙述实验步骤,直到制得纯碳酸钠溶液 。
小题4:根据给出的溶解度表,若保证在配制过程中不会有晶体析出,所用氢氧化钠溶液中含NaOH的质量分数的最大值是多少(写出计算步骤和必要的文字说明)?
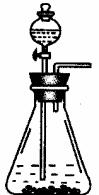
小题1:洗气瓶,烧杯,量筒;装置如下图所示:
小题2:④⑤⑥
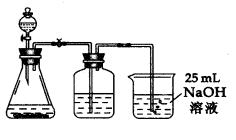
小题3:①取25 mL NaOH溶液通入过量的CO2气体,至CO2不再溶解;
②小心煮沸溶液1~2分钟,排出溶液中溶解的CO2气体;
③在得到的溶液中加入另一半(25 mL)NaOH溶液,使溶液充分混合即得纯的碳酸钠。
小题4:要保证在配制过程中不会有晶体析出,即100 g水中最多溶解8.4 g NaHCO3,根据化学方程式:NaOH+CO2=NaHCO3,生成8.4 g NaHCO3需NaOH固体4 g,NaOH溶液的质量分数最大只能为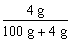 =3.85%,所以配制过程中不会有晶体析出,就必须使NaOH溶液的质量分数≤3.85%。
=3.85%,所以配制过程中不会有晶体析出,就必须使NaOH溶液的质量分数≤3.85%。
本题要求制得纯净的碳酸钠,根据题意不能在氢氧化钠中直接通二氧化碳来制纯净Na2CO3,否则不纯,因为这样二氧化碳的量很难控制,若CO2生成碳酸氢钠,若CO2不足则氢氧化钠反应不完全。所以只有把氢氧化钠分成两等份,其中一份通足量的二氧化碳使其完全生成碳酸氢钠后,再把另一份加入其中让其完全转化为碳酸钠。在制CO2时应选用较稀的盐酸,便于控制反应速率和减少HCl的干扰。
