问题
选择题
为了检验某化合物中是否含有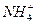 、
、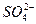 、Fe2+和结晶水,设计了下列操作步骤:①取少量该化合物加热,发现试管口处有液体,该液体能使无水硫酸铜变蓝;②另取少量该化合物溶于水中,滴加少量的氯水,再加入KSCN溶液,有血红色出现;③取少量溶液于试管中,加入盐酸,没有现象,再加入BaCl2溶液,有白色沉淀生成;④取少量溶液于试管中,加入浓的NaOH溶液,微热有使湿润的红色石蕊试纸变蓝的气体产生,同时也有白色沉淀产生,该沉淀很快变成灰绿色沉淀。
、Fe2+和结晶水,设计了下列操作步骤:①取少量该化合物加热,发现试管口处有液体,该液体能使无水硫酸铜变蓝;②另取少量该化合物溶于水中,滴加少量的氯水,再加入KSCN溶液,有血红色出现;③取少量溶液于试管中,加入盐酸,没有现象,再加入BaCl2溶液,有白色沉淀生成;④取少量溶液于试管中,加入浓的NaOH溶液,微热有使湿润的红色石蕊试纸变蓝的气体产生,同时也有白色沉淀产生,该沉淀很快变成灰绿色沉淀。
下列说法正确的有( )
A.②中的现象说明一定有Fe2+
B.为了检验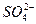 ,可以将③中的试剂换为HNO3酸化的Ba(NO3)2
,可以将③中的试剂换为HNO3酸化的Ba(NO3)2
C.通过上述实验可确定该化合物的化学式为(NH4)2Fe(SO4)2·6H2O
D.④中的沉淀长时间放置会变成红褐色沉淀
答案
答案:D
①中的现象只能说明该化合物含有结晶水;②中的现象则只能说明该化合物中含有Fe2+或Fe3+;③中的现象说明该化合物中一定含有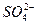 但如果用HNO3酸化的Ba(NO3)2,则
但如果用HNO3酸化的Ba(NO3)2,则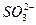 也会产生此现象,不能说明该化合物中含
也会产生此现象,不能说明该化合物中含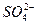 ;④中的现象说明该化合物中含Fe2+、
;④中的现象说明该化合物中含Fe2+、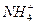 ,沉淀应为Fe(OH)2,Fe(OH)2极易被空气中的O2氧化成红褐色沉淀Fe(OH)3。通过以上现象,只能确定该化合物中含Fe2+、
,沉淀应为Fe(OH)2,Fe(OH)2极易被空气中的O2氧化成红褐色沉淀Fe(OH)3。通过以上现象,只能确定该化合物中含Fe2+、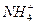 、
、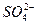 和结晶水,不能确定其化学式。故只有D正确。
和结晶水,不能确定其化学式。故只有D正确。
