某化学课外活动小组用浓盐酸、MnO2共热制Cl2,并用Cl2和Ca(OH)2反应制少量漂白粉,现已知反应2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O,正反应为放热反应,温度稍高即发生副反应6Cl2+
6Ca(OH)2=5CaCl2+Ca(ClO3)2+6H2O。甲、乙、丙三人分别设计三个实验装置,如下图所示。
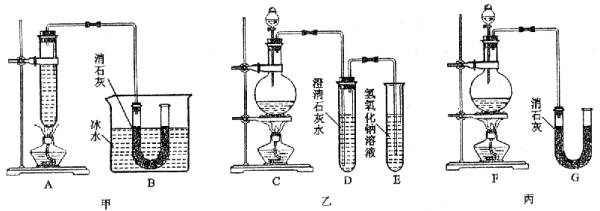
(1)请指出三个装置各处的缺点或错误(如没有可不填)
甲:_______________________________________________________;
乙:_______________________________________________________;
丙:_______________________________________________________。
(2)图甲由A、B两部分组成,乙由C、D、E三部分组成,丙由F、G组成,从上述甲、乙、丙三套装置中选出合理的部分(按气流从左到右的方向)组装一套较完善的实验装置(填所选部分的编号) ___________________________________。
(3)实验中若用12mol·L-1的浓盐酸100mL与足量的MnO2反应,最终生成Ca(ClO)2的物质的量总是小于0.15mol,其可能的主要原因是(假定各步反应均无反应物损耗且无副反应发生) _______________________________________________________。
(1)甲:①发生装置错误,该装置不能提供稳恒的气流,且反应速率不便控制;②没有尾气吸收装置,会污染环境。
乙:①没有降温装置,易使温度升高发生副反应,导致产物不纯;②应换成U形管,改装消石灰。
丙:①没有降温装置,易使温度升高发生副反应,导致产物不纯;②没有尾气处理装置,会污染环境。
(2)C(F)、B、E
(3)MnO2只能氧化浓HCl,随着反应的进行,c(Cl-)减小,还原性减弱,反应不能继续进行。
本题为制备实验方案的评价与完善,目标产物为漂白粉,由题给信息知反应必须在低温条件下进行且原料气为Cl2,故制备装置必须能提供稳恒的氯气流且必须有尾气吸收装置,据此可评价甲、乙、丙三套实验装置的优缺点。取三套装置的优点即为制备漂白粉的最佳装置。
