重晶石矿的主要成分为硫酸钡,纯净的硫酸钡才能供医用作“钡餐”,在对某些内脏器官进行X射线透视时服用。硫化钡是可溶于水的盐。讨论用重晶石矿制硫酸钡,设计流程如下:
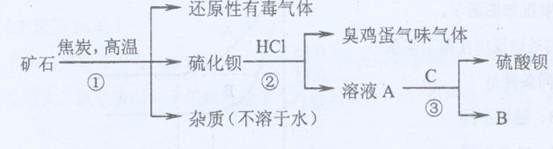 (1)写出步骤①的化学反应方程式 ,该反应产生的气体具有 、 等用途。
(1)写出步骤①的化学反应方程式 ,该反应产生的气体具有 、 等用途。
(2)为进行②反应先要分离出硫化钡溶液,采用的方法是 。在此之前要在溶液中滴入少量Ba(OH)2溶液,其作用是 。
(3)若B物质在该生产过程中可循环使用,则③反应的化学方程式是: 。
(4)有人提出②反应产生了有臭有毒的气体,可采用改变反应物的方法使无该气体产生,则②反应的化学方程式是: 。此时若要B物质还能循环使用,则C为 (写化学式)。
(5)BaSO4是因为具有 、 等性质而可用作“钡餐”的。
(1)BaSO4+4C BaS+4CO↑,作燃料、冶炼金属
BaS+4CO↑,作燃料、冶炼金属
(2)溶解过滤,防止BaS发生水解。
(3)BaC12+H2SO4→BaSO4↓+2HC1
(4)BaS+CuC12→CuS↓+BaC12 CuSO4
(5)即不溶于水也不溶于一般酸、不能被X射线透过。
本题考查流程型实验。(1)反应物为硫酸钡和碳,生成物有硫化钡,则产生的气体为CO,CO可以作为燃料、还原剂等;(2)因为S2-存在水解反应:S2-+H2O HS-+OH-,所以加入Ba(OH)2溶液的目的是抑制硫化钡水解;(3)硫化钡与盐酸反应生成H2S和BaCl2,A物质为BaCl2,因为B物质可以循环利用,则C是硫酸,产物B是盐酸,符合题意;(4)将盐酸改为CuC12,原因是CuS不溶于水和酸。
HS-+OH-,所以加入Ba(OH)2溶液的目的是抑制硫化钡水解;(3)硫化钡与盐酸反应生成H2S和BaCl2,A物质为BaCl2,因为B物质可以循环利用,则C是硫酸,产物B是盐酸,符合题意;(4)将盐酸改为CuC12,原因是CuS不溶于水和酸。