某同学用含硫酸亚铁等杂质的工业硫酸铜制取纯净的氧化铜以探究其性质。
(1)制备氧化铜
①将工业硫酸铜加适量水溶解、搅拌、过滤除去不溶性杂质。简述检验滤液中含有Fe2+的操作方法: 。
②向滤液中滴加H2O2溶液,稍加热,当Fe2+转化完全后,为将Fe3+全部转化为Fe(OH)3沉淀,而不会将Cu2+转化为沉淀,需慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制溶液pH=3.5。加热煮沸后过滤,用稀硫酸酸化滤液至pH=1。再从溶液中分离出硫酸铜晶体。Fe2+转化为Fe3+的离子方程式是 。
③在测定所得硫酸铜晶体(CuSO4·xH2O)x值的实验中,所用的玻璃仪器名称为:酒精灯、
玻璃棒、 ,实验过程中称量操作至少进行 次。
④用得到的硫酸铜晶体制氧化铜。
(2)探究氧化铜的性质
在加热条件下,向下图所示装置中持续通入某纯净物X的蒸气,a处黑色物质变为红色,b处白色粉末变为蓝色,c处有无色液体产生。(设各步反应均进行完全)
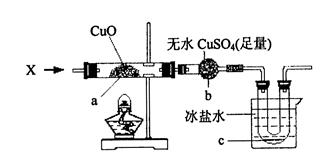
则X可能是 (填一个化学式即可),X与CuO反应的化学方程式是
。
(1)①取少量滤液于试管中,滴加少量KSCN溶液无现象,再加入少量新制的氯水,溶液呈红色,则证明溶液中含有Fe2+离子。
②2Fe2++H2O2+2H+=2Fe3++2H2O ③干燥器(1分)4次
(2)CH3CH2OH CH3CH2OH+CuO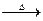 CH3CHO+H2O+Cu
CH3CHO+H2O+Cu
本题考查化学实验的基本知识及离子检验的方法。关键在于明确实验原理,各种实验操作的用途。(1)①Fe2+的检验方法是:取少量滤液于试管,先加KSCN溶液,溶液不变红色,再滴加新制的氯水,溶液呈红色,说明溶液中有Fe2+。②H2O2做氧化剂将Fe2+氧化为Fe3+,离子方程式为2Fe2++ H2O2+ 2H+ =2Fe3++ 2H2O。③干燥器,3。(2)由于a处黑色物质变为红色,无水硫酸铜变蓝,c处有无色液体产生,说明生成了水,故X为H2。 H2与CuO反应的化学方程式为H2 + CuO Cu + H2O。
Cu + H2O。
