有如下图所示六组制取漂白粉的装置,请依据题意回答问题。
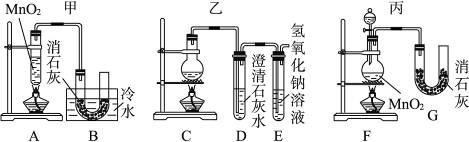
(1)有下列几项优缺点:a.不容易控制反应速率;b.容易控制反应速率;c.有副反应发生;d.可防止副反应发生;e.污染环境;f.可防止污染环境。请对上图所示的甲、乙、丙三套装置的优缺点作出评析,选择符合题目要求的选项填在下列空格内。
| 优点 | 缺点 | |
| ①甲装置 | ||
| ②乙装置 | ||
| ③丙装置 |
(3)实验中若用100 mL 12 mol·L-1的浓盐酸与足量的MnO2反应,最终生成Ca(ClO)2的物质的量总是__________(填“大于”“小于”或“等于”)0.15 mol,其原因是(假定各步反应均无反应物损耗,且用无副反应发生)________________________________________。
18.(1)①d a、e ②f a、c ③b c、e
(2)F→B→E
(3)小于 浓盐酸逐渐变稀,稀盐酸与MnO2不反应,且浓盐酸有挥发性,所以盐酸不能全部反应生成Cl2,故生成的Ca(ClO)2少于0.15 mol
要对各装置作出正确的评价,首先看清各装置的特点。甲、乙的反应物为一次性加入,不利于控制反应速率,丙用分液漏斗加浓盐酸,可以有效地控制反应效率。因制取漂白粉的反应为放热反应,随反应的进行体系温度升高将发生副反应,影响产量和质量。甲中Cl2与消石灰的反应在冷水浴中进行有效地克服了这一缺点。Cl2是一种大气污染物,乙中有NaOH溶液吸收尾气中的Cl2,防止了环境污染。
从理论上说,100 mL 12 mol·L-1的浓盐酸反应生成0.15 mol的Ca(ClO)2,但浓盐酸有挥发性,且随反应的进行盐酸浓度减小,稀盐酸将不再与MnO2反应生成Cl2,故实际上,盐酸中的HCl并不能全部参与反应。
