某课外小组在实验室制备氨气,并进行有关氨气的用途及性质的探究。
(1)写出实验室制取氨气的化学方程式: 。
(2)合成氨对化学和国防工业具有重要意义。写出氨的两种重要用途:
① ② 。
(3)该小组同学设计下图所示装置探究氨气的还原性。
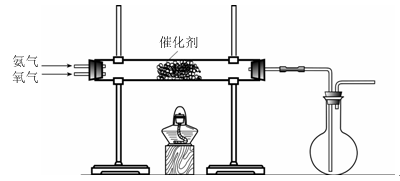
①氨催化氧化的化学方程式为 。
②若实验时通入氨气的速率过快,在烧瓶中会出现白烟,该物质的化学式为 。
(4)该小组同学欲以氨气和二氧化碳为原料制备少量较纯净的碳酸铵溶液设计如下甲乙两方案。
①甲方案:先将二氧化碳通入水中,充分溶解后,再通入氨气;
乙方案:先将氨气通入水中,充分溶解后,再通入二氧化碳。
合理的方案是: ,理由是 。
②检验产物中有NH4+的方法为 。
③用氢键表示式写出氨水中存在的所有氢键 。
(1)2NH4Cl+Ca(OH)2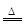 2NH3↑+CaCl2+2H2O (1分)
2NH3↑+CaCl2+2H2O (1分)
(2)①制化肥 ②制硝酸(共2分)
(3)① 4NH3 + 5O2 4NO + 6H2O ②NH4NO3 (共4分)
4NO + 6H2O ②NH4NO3 (共4分)
(4)①甲方案。(2分) 甲方案反应终点较易控制乙方案反应终点较难控制或
二氧化碳在水中溶解度较小,氨气在水中溶解度很大先通入二氧化碳,再通入氨气碱过量生成正盐(1分)
②取少量产物放入试管中,加入浓NaOH溶液,加热,在试管口放置湿润的红色石蕊试纸,若试纸变蓝,则证明产物中有NH4+。(2分)
③ N-H…N O-H…O O-H…N N-H…O (写对1个1分共4分)
(1)实验室制氨气是中学化学教学的重要知识点需要熟记即:2NH4Cl+Ca(OH)2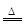 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O
(2)氨的重要用图在于是重要的工业原料如①制化肥 ②制硝酸等
(3)①4NH3 + 5O2 4NO + 6H2O
4NO + 6H2O
②若实验时通入氨气的速率过快,则氨气过量,由于氨催化氧化过程中有水生成,而产物一氧化氮极易被氧化成二氧化氮,二氧化氮遇谁有硝酸生成,硝酸遇过量的氨生成颗粒状硝酸铵,而产生白烟,故该物质的化学式为NH4NO3。
(4)①以氨气和二氧化碳为原料制备少量较纯净的碳酸铵溶液合理的方案是甲,主要考虑二氧化碳在水中溶解度较小,氨气在水中溶解度很大先通入二氧化碳,再通入氨气碱过量生成正盐,反之很可能有酸式盐碳酸氢钠生成,导致产物不纯。
②检验铵根的方法有两种:取少量产物放入试管中,加入浓NaOH溶液,加热,在试管口放置湿润的红色石蕊试纸或蘸有浓盐酸的玻璃棒,若试纸变蓝或产生白烟,则证明产物中有NH4+。
③据氢键产生于氢原子与分子间所含的电负性较强的氟原子、氧原子及氮原子间,故氨水中的氢键可表示为N-H…N O-H…O O-H…N N-H…O
