某NaOH固体中含有Na2CO3.老师安排第一小组做除去NaOH固体中Na2CO3的实验.第二、第三小组同学做测定该固体混合物中Na2CO3质量分数的实验.
Ⅰ,第一小组的同学取一定量的该固体溶于水,得到混合溶液,为了除去溶液中的Na2CO3杂质,甲、乙、丙、丁四位同学分别选择下列试剂进行实验.其中合理的是______.
甲:适量稀盐酸 乙:过量KOH溶液 丙:适量Ba(OH)2溶液 丁:适量CaCl2溶液.
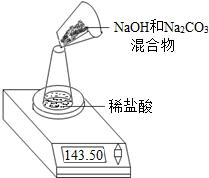
Ⅱ,第二小组利用左下图装置测定NaOH和Na2CO3的混合物中Na2CO3的质量分数,用电子天平称量数据如下表:则混合物中Na2CO3的质量分数为______.
| 称量项目 | 质量(g) |
| NaOH和Na2CO3的混合物 | 9.30 |
| 锥形瓶+稀盐酸质量(过量) | 141.20 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物(反应开始后15秒) | 148.50 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物(反应开始后35秒) | 148.30 |
| 锥形瓶+稀盐酸质量+全部NaOH和Na2CO3的混合物(反应开始后55秒) | 148.30 |

(1)A是______(填化学式).
(2)B操作的名称是______.该实验要求加入的A溶液必须过量,检查A溶液已经过量的方法是______.
(3)混合物中Na2CO3的质量分数为______(用a、b表示)
I:除去氢氧化钠中的碳酸钠,所选物质含氢氧根,且能将碳酸根除去,故想到氢氧化钙和氢氧化钡可氢氧化钙微溶,所以选氢氧化钡,所以选丙.若选甲盐酸,盐酸即与碳酸钠反应也和氢氧化钠反应,故甲方案不行.乙氢氧化钾和碳酸钠不反应.丁氯化钙和碳酸钠生成碳酸钙沉淀,同时若氯化钙过量也会和氢氧化钠反应生成少量的氢氧化钙和碳酸钠,故还有杂质,故丁方案不行.
II:由图表知最多产生的二氧化碳的质量是2.2g,故设混合物中碳酸钠的质量为x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
x 2.2g
=106 x 44 2.2g
解得:x=5.3g
混合物中碳酸钙的质量分数为:
×100%=57%53 93
III:通过第二步操作得到碳酸钙沉淀,故加入的A溶液能与碳酸钠反应生成碳酸钙沉淀,检查A是否过量,就看上层清液中是否含有氯化钙或氢氧化钙,加入碳酸钠检验;
(3)设固体混合物中碳酸钠的质量为y,
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
106 100
y bg
=106 y 100 bg
y=
g106b 100
固体混合物中碳酸钠的质量分数为
=
g106b 100 ag 106b 100a
故答案:(1)CaCl2或Ca(OH)2(其它答案合理即得分),(2)过滤 取加入A溶液反应后,上层清液于试管中,加入碳酸钠溶液,如果产生白色沉淀,说明A溶液已经过量.(3)106b 100a
