某化学小组利用浓盐酸和二氧化锰在加热条件下制取氯气,并利用氯气进行有关的探究实验 ,制取氯气的装置如图I和Ⅱ。
,制取氯气的装置如图I和Ⅱ。
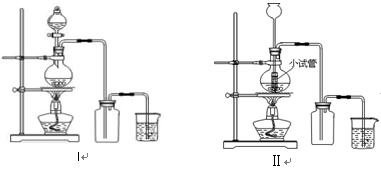
(1)制取氯气的反应的离子方程式 ;
(2)装置Ⅱ中小试管的作用为 ;
(3)装置I与装置Ⅱ比较,装置I的主要优点为: 。
(4)将生成的氯气通入水中,可制得氯水,氯水见光易分解生成 气体。
(5)氯气能使湿润的红色布条褪色。对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能,请利用中学实验室常见试剂,设计实验,得出正确结论。
| 提出问题 | 收集资料 | 提出假设 | 验证假设 | 得出结论 |
| 氯水中何种物质能使湿润的红色布条褪色? | ①Cl2有强氧化性 ②Cl2与冷水反应生成盐酸和HClO ③HClO有强氧化性 | ① 。 ②盐酸使布条褪色。 ③ 。 ④H2O使布条褪色 | 验证假设①:把红色干布条放入充Cl2的集气瓶,布条不褪色; 验证假设②: 。 验证假设④:把红色布条放在水里,布条不褪色。 | 使红色布条褪色的物质是 。 |
(共16分)(1)MnO2+ 4H++ 2Cl—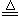 Mn2++ 2H2O + Cl2 ↑ (2分)
Mn2++ 2H2O + Cl2 ↑ (2分)
(2)液封或防止气体溢出(2分)
(3)便于控制滴加浓盐酸,减少浓盐酸的挥发 或操作简便(2分)
(4)氧气 (2分)
(5)氯气使布条褪色 (2分) HClO使布条褪色 (2分)
把红色布条放在盐酸溶液里不褪色(2分) HClO (2分)
